
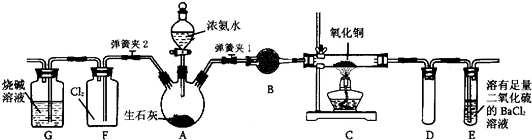
分析 (1)检验装置的气密性一般先形成封闭体系,然后微弱观察插入液面以下的导管口是否有气泡生成,停止加热后,导管形成一段水柱;
(2)依据氨气为碱性气体,应选择碱性干燥剂,氨气极易溶于水,溶液发生倒吸解答;
(3)反应后的尾气中含有未反应的氨气,氨气在E溶液中与二氧化硫反应生成亚硫酸铵,亚硫酸铵与氯化钡反应生成亚硫酸钡;
装置C中黑色固体逐渐变红,说明有Cu生成,从E中逸出液面的气体可以直接排入空气,说明氨气被氧化为氮气,同时生成水;
(4)反应前固体质量为16g,反应后称重固体质量减少2.4g,剩余固体质量为16g-2.4g=13.6g,计算剩余固体中Cu、O质量,进而计算n(Cu):n(O)确定组成;
(5)氯气有强氧化性,氧化氨气生成N2,产生白烟,说明生成固体,故还生成NH4Cl;
盛满氯气的集气瓶中因氨气消耗氯气生成部分固体,导致内压减小,引起溶液倒吸.
解答 解:(1)组装好装置后,若要检验A-E装置的气密性,其操作是:首先关闭弹簧夹2和分液漏斗活塞,打开弹簧夹1,在E中装入水后,然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成说明装置气密性良好,
故答案为:关闭弹簧夹2和分液漏斗活塞,打开弹簧夹1,在E中装入水;
(2)氨气为碱性气体,应选择碱性干燥剂碱石灰或者生石灰;氨气极易溶于水,溶液发生倒吸,装置D为安全瓶可以防止倒吸;
故答案为:碱石灰 (生石灰);防止倒吸;
(3)反应后的尾气中含有未反应的氨气,氨气在E溶液中与二氧化硫反应生成亚硫酸铵,亚硫酸铵与氯化钡反应生成亚硫酸钡,故还有白色沉淀沉淀,
装置C中黑色固体逐渐变红,说明有Cu生成,从E中逸出液面的气体可以直接排入空气,说明氨气被氧化为氮气,同时生成水,C中发生反应的化学方程式为:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O,
故答案为:白色沉淀;2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O;
(4)16gCuO中含有Cu元素质量为16g×$\frac{65}{80}$=12.8g,含有氧元素质量为16g-12.8g=3.2g,反应后称重固体质量减少2.4g,剩余固体质量为16g-2.4g=13.6g,大于12.8g,故剩余固体含有Cu、O元素,故n(Cu)=$\frac{12.8g}{64g/mol}$=0.2mol,含有O元素的质量为13.6g-12.8g=0.8g,n(O)=$\frac{0.8g}{16g/mol}$=0.05mol,n(Cu):n(O)=0.2mol:0.05mol=4:1>2:1,故剩余固体为Cu2O、Cu,
故答案为:Cu2O、Cu;
(5)氯气有强氧化性,氧化氨气生成N2,产生白烟,说明生成固体,故还生成NH4Cl,反应方程式为:3Cl2+8NH3=N2+6NH4Cl.盛满氯气的集气瓶中因氨气消耗氯气生成部分固体,导致内压减小,引起溶液倒吸,
故答案为:3Cl2+8NH3=N2+6NH4Cl;盛满氯气的集气瓶中因氨气消耗氯气生成部分固体,导致内压减小,引起溶液倒吸.
点评 本题考查氨气的制备与性质实验、对装置的理解、实验操作、化学计算等,掌握氨气的性质、明确氨气制备的原理是解题关键,侧重考查学生实验能力和分析能力,题目难度中等.


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 在有机物中碳原子与其他原子最多形成4 个共价键 | |
| B. | 用溴的四氯化碳溶液既可以鉴别甲烷和乙烯,也可以除去甲烷中的乙烯 | |
| C. | 煤干馏后的煤焦油中含有苯、甲苯、二甲苯等有机物,可以通过萃取的方法将其提纯出来 | |
| D. | 用酸性高锰酸钾溶液可以鉴别己烷和甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素丙的单质可用于冶炼金属 | B. | 丙与丁形成的化合物能升华 | ||
| C. | 甲与乙形成的化合物溶于水呈酸性 | D. | 简单离子半径:丁>乙>丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焰火中呈现的绚丽色彩,是各种金属元素焰色反应形成的 | |
| B. | 小苏打既是制作糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| C. | 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰 | |
| D. | 装运乙醇的包装箱上应贴上易燃液体的危险品标志图标 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,加稀硫酸酸化,然后再滴入几滴品红溶液; | 现象:品红不褪色 结论:假设1不成立; |
| 步骤2:另取少量吸收液于试管中, 滴入几滴KSCN溶液. | 现象:溶液变红 结论:假设2成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molCu和足量热浓硫酸反应可生成SO3分子数为0.1NA | |
| B. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA | |
| C. | 常温常压下,6.0g SiO2含有的SiO2分子数为0.1NA | |
| D. | 工业上将氨气与氧气在催化剂作用下发生氧化反应,若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数NA可表示为:$\frac{22.4n}{5V}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com