
分析 (1)Na、K能和水反应生成氢气,在氧气中燃烧生成过氧化物,过氧化钠和水、二氧化碳反应都生成氧气,促进钠、钾燃烧;
(2)氯化铵属于离子化合物,含有离子键和共价键;
(3)NaCN属于离子化合物,C、N原子周围都是8个电子;Na+原子核外有10个电子;根据C的电子排布判断;N的原子核有7个电子,最外层有5个;比较两种元素的非金属性强弱,可根据单质之间的置换反应、与氢气反应的难易程度、氢化物的稳定性以及最高正价氧化物对应水化物酸性强弱;
(4)根据元素守恒确定X中元素,根据转移电子守恒、原子守恒确定X化学式;
(5)根据题意可知,酸性条件下CNO-与NaClO反应生成N2、CO2和Cl2,根据氧化还原反应配平.
解答 解:(1)Na、K能和水反应生成氢气,在氧气中燃烧生成过氧化物,过氧化钠和水、二氧化碳反应都生成氧气,促进钠、钾燃烧,所以应该采用细沙灭火,
故答案为:D;
(2)氯化铵属于离子化合物,含有离子键和共价键,氯化铵分解时破坏了共价键和离子键;
故答案为:离子键、共价键;
(3)NaCN属于离子化合物,C、N原子周围都是8个电子,其电子式为:Na+[:C┇┇N:]-;Na+原子核外有10个电子,每个电子一种运动状态,共10种运动状态不同的电子;C的电子排布式为1s22s22p2,共有3种能量不同的电子;N的原子核有7个电子,最外层有5个,根据其电子式可知,含有1个孤电子对;
A.相同条件下水溶液的pH:NaHCO3>NaNO3,说明硝酸的酸性强于碳酸,则证明非金属性N>C,故A正确;
B.酸性:HNO2>H2CO3,由于亚硝酸不是N元素的最高价氧化物对应的水化物,无法比较二者的非金属性大小,故B错误;
C、CH4的稳定性比NH3弱,与实际不符,故C错误;
D、C 与H2的化合比N2与H2的化合更困难,与实际不符,故D错误;
故答案为:Na+[:C┇┇N:]-;10;3;1;A;
(4)根据元素守恒知,X中含有Na、C元素,该反应中N元素化合价由-3价转化为0价、NaCN中C元素化合价为+2价,则C元素化合价由+2价转化为+4价,转移电子数为6,根据转移电子守恒、原子守恒知X为NaHCO3,
故答案为:NaHCO3;
(5)根据题意可知,酸性条件下CNO-与NaClO反应生成N2、CO2和Cl2,反应离子方程式为2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O;
故答案为:2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O..
点评 本题考查了元素化合物的性质、电子式、化学键、非金属性强弱比较、氧化还原反应等,侧重于考查学生的对基础知识的应用能力,注意把握元素化合物的性质以及反应中元素的化合价变化为解答的关键,题目难度中等.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
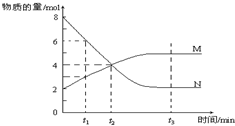
| A. | 该反应的化学方程式为:2 M?N | |
| B. | t1时,V正>V逆 | |
| C. | t2时,V正=V逆,达到平衡 | |
| D. | t 3时,M、N的浓度不再发生变化,反应停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>Y>X | |
| B. | 最高价氧化物的水化物的酸性:Y>Z | |
| C. | 化合物WZ2中各原子均满足8电子的稳定结构 | |
| D. | Y、Z均能与碳元素形成共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
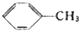 $→_{△}^{KMnO_{4}}$
$→_{△}^{KMnO_{4}}$ $\stackrel{HCl}{→}$
$\stackrel{HCl}{→}$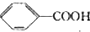
| 名称 | 相对分子质量 | 性状 | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 92 | 无色液体、易燃、易挥发 | -95 | 110.6 | 不溶 | 互溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 112.4(100℃升华) | 248 | 微溶 | 易溶 |
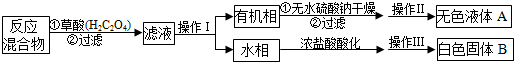
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  | 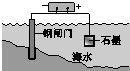 |
| 钢铁表面水膜的酸性很弱或呈中性,发生吸氧腐蚀 | 钢铁表面水膜的酸 性较强,发生析氢 腐蚀 | 将锌板换成铜板对 钢闸门保护效果更好 | 钢闸门作为阴极而受到保护 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砷元素的最高化合价为+3 | B. | 砷元素是第四周期的主族元素 | ||
| C. | 砷原子的次外层上有8个电子 | D. | 砷的氧化物的水化物是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与H2化合时,X单质比Y单质容易 | |
| B. | X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 | |
| C. | X原子的原子序数比Y原子的原子序数大 | |
| D. | X单质可以把Y从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2>HI>H2SO3 | B. | HI>FeCl2>H2SO3 | C. | H2SO3>HI>FeCl2 | D. | FeCl2>H2SO3>HI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
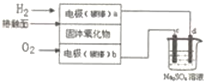
| A. | 电路中电子流向为a→d→c→b | |
| B. | 电极b为负极,电极反应式为O2+4e一=2O2- | |
| C. | 电解后烧杯中溶液pH增大 | |
| D. | 理论上b极消耗气体和c极生成气体质量相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com