
氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
① 工业合成氨的热化学方程式是 。
② 若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则
Q(填“>”、“<”或“=”)_______184.4 kJ。
③ 已知:

1 mol N-H键断裂吸收的能量约等于_______kJ。
| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
①焓变ΔH(填“>”、“<”或“=”) 0
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比) ,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
 ③ 上图中的B点处,NH3的平衡转化率为_______。
③ 上图中的B点处,NH3的平衡转化率为_______。
(3)氮气是制备含氮化合物的一种重要物质,而氮的化合物用途广泛。
 下面是利用氮气制备含氮化合物的一种途径:
下面是利用氮气制备含氮化合物的一种途径:
①过程Ⅱ的化学方程式是
②运输时,严禁NH3与卤素(如Cl2)混装运输。若二者接触时剧烈反应产生白烟,并且0.4 mol NH3参加反应时有0.3 mol 电子转移。写出反应的化学方程式
③氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。
已知:4NH3(g) + 3O2(g) == 2N2(g) + 6H2O(g) ΔH = —1316 kJ/mol,则该燃料电池的负极反应式是
科目:高中化学 来源: 题型:
化学与人类生产、生活、社会可持续发展密切相关。下列说法不正确的是
A.光化学烟雾是氮氧化物受紫外线照射后产生的O3直接与空气中的一些碳氢化合物作用后生成的一种有毒烟雾
B.石油液化气、汽油和石蜡的主要成分都是碳氢化合物
C.绿色化学的核心是应用化学原理对环境污染进行治理
D.“天宫一号”中使用的碳纤维,是一种新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
在pH=1的无色溶液中能大量共存的离子组是
A.NH4+、Mg2+、SO42-、Cl- B.Ba2+、K+、OH-、NO3-
C.Al3+、Cu2+、SO42-、Cl- D.Na+、Ca2+、Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在250mL容量瓶中定容成250mL烧碱溶液;
B.用碱式滴定管移取25mL烧碱溶液于锥形瓶中并滴加几滴甲基橙作指示剂;
C.在天平上准确称取烧碱样品mg,在烧杯中加蒸馏水溶解;
D.将物质的量浓度为C mol·L-1的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度为V1mL;
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL。
回答下列问题:
(1)正确操作步骤的顺序是(用字母填写) 

 D
D  。
。
(2)操作E中的锥形瓶下垫一张白纸的作用是 。
(3)操作D中液面应调整到 。
(4)滴定终点的现象是 。
(5)若酸式滴定管没有用标准H2SO4润洗,会对测定结果有何影响? (填“偏高”、“偏低”或“无影响”,其它操作均正确)。
(6)该烧碱样品的纯度计算式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是烧杯中………………………………………………………………….( )
A.有铁无铜 B.有铜无铁 C.铁、铜都有 D.铁、铜都无
查看答案和解析>>
科目:高中化学 来源: 题型:
把aL含硫酸铵和硝酸铵的混合液分 成两等份,一份需用b mol烧碱刚好把氨全部赶出,另一份与氯化钡溶液反应时,消耗c mol氯化钡,由此可知原溶液中N03—的物质的量浓度是(单位:mol·L—1)………………………………………………………( )
成两等份,一份需用b mol烧碱刚好把氨全部赶出,另一份与氯化钡溶液反应时,消耗c mol氯化钡,由此可知原溶液中N03—的物质的量浓度是(单位:mol·L—1)………………………………………………………( )
A. B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
由下列实验事实得出结论错误的是
A.蔗糖加入浓硫酸后变黑,说明浓硫酸具有脱水性
B.浓硫酸可用作气体干燥剂,说明浓硫酸具有吸水性
C.铜与浓硫酸共热有刺激性气味气体放出,说明浓硫酸具有强氧化性
D. SO2能使紫红色的酸性高锰酸钾溶液褪色,说明SO2具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:① 2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
② 稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol,
下列结论正确的是
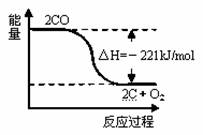
A.碳的燃烧热大于110.5 kJ/mol
B.右图可表示①的反应过程和能量关系
C.稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com