
ЁОЬтФПЁПФГПЮЭтаЁзщдкЪЕбщЪвжЦБИАБЦјЃЌВЂНјаагаЙиАБЦјЕФаджЪЬНОПЃЎ
![]() ИУаЁзщЭЌбЇМгШШЩњЪЏЛвгыТШЛЏяЇЕФЛьКЯЮяжЦШЁИЩдяЕФАБЦјЃЎ
ИУаЁзщЭЌбЇМгШШЩњЪЏЛвгыТШЛЏяЇЕФЛьКЯЮяжЦШЁИЩдяЕФАБЦјЃЎ
![]() гІИУбЁгУЕФвЧЦїМАзАжУга
гІИУбЁгУЕФвЧЦїМАзАжУга![]() ЬюзжФИ
ЬюзжФИ![]() ______ ЃЎ
______ ЃЎ
![]() ЩњЪЏЛвгыТШЛЏяЇЗДгІЩњГЩАБЦјЕФЛЏбЇЗНГЬЪНЮЊ ______ ЃЎ
ЩњЪЏЛвгыТШЛЏяЇЗДгІЩњГЩАБЦјЕФЛЏбЇЗНГЬЪНЮЊ ______ ЃЎ
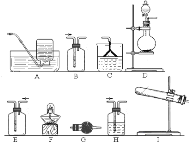
![]() ИУаЁзщЭЌбЇЩшМЦШчЭМЫљЪОзАжУЬНОПАБЦјЕФЛЙдадЃЎ
ИУаЁзщЭЌбЇЩшМЦШчЭМЫљЪОзАжУЬНОПАБЦјЕФЛЙдадЃЎ

дкЩЯЪіЙ§ГЬЛсЭЌЪБЗЂЩњЖрИіЗДгІЃЌаДГіЦфжаЪєгкжУЛЛЗДгІЕФЛЏбЇЗНГЬЪН ______ ![]() ШєЪЕбщЪБЭЈШыАБЦјЕФЫйТЪЙ§ПьЃЌдкЩеЦПжаЛсГіЯжАзбЬЃЌИУЮяжЪЕФЛЏбЇЪНЮЊ ______ ЃЎ
ШєЪЕбщЪБЭЈШыАБЦјЕФЫйТЪЙ§ПьЃЌдкЩеЦПжаЛсГіЯжАзбЬЃЌИУЮяжЪЕФЛЏбЇЪНЮЊ ______ ЃЎ
![]() ИУаЁзщЭЌбЇвдАБЦјКЭЖўбѕЛЏЬМЮЊдСЯжЦБИЬМЫсЧтяЇЃЎ
ИУаЁзщЭЌбЇвдАБЦјКЭЖўбѕЛЏЬМЮЊдСЯжЦБИЬМЫсЧтяЇЃЎ
![]() МзЭЌбЇЯШНЋЖўбѕЛЏЬМЭЈШыЫЎжаЃЌГфЗжШмНтКѓЃЌдйЭЈШыАБЦјЃЛввЭЌбЇЯШНЋАБЦјЭЈШыЫЎжаЃЌГфЗжШмНтКѓЃЌдйЭЈШыЖўбѕЛЏЬМЃЎКЯЪЪЕФЗНАИЪЧ ______
МзЭЌбЇЯШНЋЖўбѕЛЏЬМЭЈШыЫЎжаЃЌГфЗжШмНтКѓЃЌдйЭЈШыАБЦјЃЛввЭЌбЇЯШНЋАБЦјЭЈШыЫЎжаЃЌГфЗжШмНтКѓЃЌдйЭЈШыЖўбѕЛЏЬМЃЎКЯЪЪЕФЗНАИЪЧ ______ ![]() ЬюЁАМзЁБЛђЁАввЁБ
ЬюЁАМзЁБЛђЁАввЁБ![]() ЃЌдвђЪЧ ______ ЃЎ
ЃЌдвђЪЧ ______ ЃЎ
![]() МьбщВњЮяжага
МьбщВњЮяжага![]() ЕФЗНЗЈЮЊ ______ ЃЎ
ЕФЗНЗЈЮЊ ______ ЃЎ
ЁОД№АИЁПIЁЂFЁЂGЁЂEЁЂC ![]() ,
, ![]()
![]() вв ЖўбѕЛЏЬМдкЫЎжаШмНтЖШНЯаЁЃЌЯШЭЈШыЖўбѕЛЏЬМЃЌдйЭЈШыАБЦјЃЌЩњГЩЕФВњЮяСПЩйЃЌЧввзЩњГЩЬМЫсяЇЃЛАБЦјдкЫЎжаШмНтЖШКмДѓЃЌЯШЭЈШыАБЦјЃЌдйЭЈШы
вв ЖўбѕЛЏЬМдкЫЎжаШмНтЖШНЯаЁЃЌЯШЭЈШыЖўбѕЛЏЬМЃЌдйЭЈШыАБЦјЃЌЩњГЩЕФВњЮяСПЩйЃЌЧввзЩњГЩЬМЫсяЇЃЛАБЦјдкЫЎжаШмНтЖШКмДѓЃЌЯШЭЈШыАБЦјЃЌдйЭЈШы![]() ЃЌЩњГЩЕФВњЮяСПЖрЃЌЧввзЩњГЩЬМЫсЧтяЇ ШЁЩйСПВњЮяЗХШыЪдЙмжаЃЌМгШыХЈNaOHШмвКЃЌМгШШЃЌдкЪдЙмПкЗХжУЪЊШѓЕФКьЩЋЪЏШяЪджНЃЌШєЪджНБфРЖЃЌдђжЄУїВњЮяжага
ЃЌЩњГЩЕФВњЮяСПЖрЃЌЧввзЩњГЩЬМЫсЧтяЇ ШЁЩйСПВњЮяЗХШыЪдЙмжаЃЌМгШыХЈNaOHШмвКЃЌМгШШЃЌдкЪдЙмПкЗХжУЪЊШѓЕФКьЩЋЪЏШяЪджНЃЌШєЪджНБфРЖЃЌдђжЄУїВњЮяжага![]()
ЁОНтЮіЁП
ЃЈ1ЃЉ![]() ЪЕбщЪвжЦБИАБЦјгУЪьЪЏЛвгУТШЛЏяЇдкМгШШЬѕМўЯТжЦБИАБЦјЃЌАБЦјЮЊМюадЦјЬхЧвМЋвзШмгкЫЎЃЌОнДЫзїД№ЃЛ
ЪЕбщЪвжЦБИАБЦјгУЪьЪЏЛвгУТШЛЏяЇдкМгШШЬѕМўЯТжЦБИАБЦјЃЌАБЦјЮЊМюадЦјЬхЧвМЋвзШмгкЫЎЃЌОнДЫзїД№ЃЛ
![]() АБЦјМгШШЪБЗжНтЩњГЩАБЦјКЭТШЛЏЧтЦјЬхЃЌТШЛЏЧтгыбѕЛЏИЦЗДгІЩњГЩТШЛЏИЦКЭЫЎЃЛ
АБЦјМгШШЪБЗжНтЩњГЩАБЦјКЭТШЛЏЧтЦјЬхЃЌТШЛЏЧтгыбѕЛЏИЦЗДгІЩњГЩТШЛЏИЦКЭЫЎЃЛ
ЃЈ2ЃЉжУЛЛЗДгІЮЊвЛжжЕЅжЪКЭвЛжжЛЏКЯЮяЗДгІЩњГЩаТЕФЕЅжЪКЭаТЕФЛЏКЯЮяЕФЗДгІЃЛгаАзбЬЩњГЩЫЕУїЩњГЩСЫвЛжжЙЬЬхЃЛ
ЃЈ3ЃЉ![]() ЖўбѕЛЏЬМЮЂШмгкЫЎЃЌШнвзБЛМюадШмвКЮќЪеЃЛ
ЖўбѕЛЏЬМЮЂШмгкЫЎЃЌШнвзБЛМюадШмвКЮќЪеЃЛ
![]() НЋяЇИљзЊЛЏГЩАБЦјНјааМьбщЁЃ
НЋяЇИљзЊЛЏГЩАБЦјНјааМьбщЁЃ
![]() ЪЕбщЪвжЦБИАБЦјгУЪьЪЏЛвгУТШЛЏяЇдкМгШШЬѕМўЯТжЦБИАБЦјЃЌАБЦјЮЊМюадЦјЬхЃЌгІгУМюЪЏЛвИЩдяЃЌПЩгУХХПеЦјЗЈЪеМЏЃЌАБЦјМЋвзШмгкЫЎЃЌЮВЦјЮќЪегІЗРжЙШмвКЕЙЮќЃЌЫљгУЕФзАжУЗжБ№гаIЁЂFЁЂGЁЂEЁЂCЃЌЙЪД№АИЮЊЃКIЁЂFЁЂGЁЂEЁЂCЃЛ
ЪЕбщЪвжЦБИАБЦјгУЪьЪЏЛвгУТШЛЏяЇдкМгШШЬѕМўЯТжЦБИАБЦјЃЌАБЦјЮЊМюадЦјЬхЃЌгІгУМюЪЏЛвИЩдяЃЌПЩгУХХПеЦјЗЈЪеМЏЃЌАБЦјМЋвзШмгкЫЎЃЌЮВЦјЮќЪегІЗРжЙШмвКЕЙЮќЃЌЫљгУЕФзАжУЗжБ№гаIЁЂFЁЂGЁЂEЁЂCЃЌЙЪД№АИЮЊЃКIЁЂFЁЂGЁЂEЁЂCЃЛ
![]() АБЦјМгШШЪБЗжНтЩњГЩАБЦјКЭТШЛЏЧтЦјЬхЃЌТШЛЏЧтгыбѕЛЏИЦЗДгІЩњГЩТШЛЏИЦКЭЫЎЃЌЩњЪЏЛвгыТШЛЏяЇЗДгІЕФЛЏбЇЗНГЬЪНЮЊ
АБЦјМгШШЪБЗжНтЩњГЩАБЦјКЭТШЛЏЧтЦјЬхЃЌТШЛЏЧтгыбѕЛЏИЦЗДгІЩњГЩТШЛЏИЦКЭЫЎЃЌЩњЪЏЛвгыТШЛЏяЇЗДгІЕФЛЏбЇЗНГЬЪНЮЊ ![]() ЃЌ
ЃЌ
ЙЪД№АИЮЊЃК![]() ЃЛ
ЃЛ
![]() АБЦјОпгаЛЙдадЃЌдкМгШШЬѕМўЯТгыбѕЦјЗЂЩњжУЛЛЗДгІЩњГЩЕЊЦјКЭЫЎЃЌЗДгІЕФЗНГЬЪНЮЊ
АБЦјОпгаЛЙдадЃЌдкМгШШЬѕМўЯТгыбѕЦјЗЂЩњжУЛЛЗДгІЩњГЩЕЊЦјКЭЫЎЃЌЗДгІЕФЗНГЬЪНЮЊ![]() ЃЌАБЦјЛЙФмБЛбѕЛЏЮЊNOКЭЫЎЃЌНјЖјгыбѕЦјЗДгІЩњГЩЯѕЫсЃЌШчЭЈШыАБЦјЙ§ПьЃЌдђЛсЩњГЩ
ЃЌАБЦјЛЙФмБЛбѕЛЏЮЊNOКЭЫЎЃЌНјЖјгыбѕЦјЗДгІЩњГЩЯѕЫсЃЌШчЭЈШыАБЦјЙ§ПьЃЌдђЛсЩњГЩ![]() ЃЌВњЩњАзбЬЃЌ
ЃЌВњЩњАзбЬЃЌ
ЙЪД№АИЮЊЃК![]() ЃЛ
ЃЛ![]() ЃЛ
ЃЛ
![]() ЖўбѕЛЏЬМЮЂШмгкЫЎЃЌЯШЭЈШыЖўбѕЛЏЬМЃЌШмвКжаЩњГЩМЋЩйСПЕФЬМЫсЃЌдйЭЈШыАБЦјЃЌЩњГЩЕФВњЮяСПЩйЃЌЧввзЩњГЩЬМЫсяЇЃЌАБЦјдкЫЎжаШмНтЖШКмДѓЃЌЯШЭЈШыАБЦјЃЌШмвКжаЩњГЩНЯЖрЕФвЛЫЎКЯАБЃЌдйЭЈШы
ЖўбѕЛЏЬМЮЂШмгкЫЎЃЌЯШЭЈШыЖўбѕЛЏЬМЃЌШмвКжаЩњГЩМЋЩйСПЕФЬМЫсЃЌдйЭЈШыАБЦјЃЌЩњГЩЕФВњЮяСПЩйЃЌЧввзЩњГЩЬМЫсяЇЃЌАБЦјдкЫЎжаШмНтЖШКмДѓЃЌЯШЭЈШыАБЦјЃЌШмвКжаЩњГЩНЯЖрЕФвЛЫЎКЯАБЃЌдйЭЈШы![]() ЃЌЩњГЩЕФВњЮяСПЖрЃЌЧввзЩњГЩЬМЫсЧтяЇЃЌЙЪввЗНАИе§ШЗЃЎ
ЃЌЩњГЩЕФВњЮяСПЖрЃЌЧввзЩњГЩЬМЫсЧтяЇЃЌЙЪввЗНАИе§ШЗЃЎ
ЙЪД№АИЮЊЃКввЃЛЖўбѕЛЏЬМдкЫЎжаШмНтЖШНЯаЁЃЌЯШЭЈШыЖўбѕЛЏЬМЃЌдйЭЈШыАБЦјЃЌЩњГЩЕФВњЮяСПЩйЃЌЧввзЩњГЩЬМЫсяЇЃЛ АБЦјдкЫЎжаШмНтЖШКмДѓЃЌЯШЭЈШыАБЦјЃЌдйЭЈШы![]() ЃЌЩњГЩЕФВњЮяСПЖрЃЌЧввзЩњГЩЬМЫсЧтяЇЃЛ
ЃЌЩњГЩЕФВњЮяСПЖрЃЌЧввзЩњГЩЬМЫсЧтяЇЃЛ
![]() Мьбщ
Мьбщ![]() РызгЪБЃЌМгШыМюдкМгШШЬѕМўЯТЗДгІЩњГЩАБЦјЃЌАБЦјЫЎШмвКГЪМюадЃЌПЩЪЙЪЊШѓЕФКьЩЋЪЏШяЪджНБфРЖЃЌ
РызгЪБЃЌМгШыМюдкМгШШЬѕМўЯТЗДгІЩњГЩАБЦјЃЌАБЦјЫЎШмвКГЪМюадЃЌПЩЪЙЪЊШѓЕФКьЩЋЪЏШяЪджНБфРЖЃЌ
ЙЪД№АИЮЊЃКШЁЩйСПВњЮяЗХШыЪдЙмжаЃЌМгШыХЈNaOHШмвКЃЌМгШШЃЌдкЪдЙмПкЗХжУЪЊШѓЕФКьЩЋЪЏШяЪджНЃЌШєЪджНБфРЖЃЌдђжЄУїВњЮяжага![]() ЃЎ
ЃЎ


 ЛюСІПЮЪБЭЌВНСЗЯАВсЯЕСаД№АИ
ЛюСІПЮЪБЭЌВНСЗЯАВсЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП(1)аюЕчГиЪЧвЛжжЗДИДГфЕчЁЂЗХЕчЕФзАжУЁЃгавЛжжаюЕчГидкГфЕчКЭЗХЕчЪБЗЂЩњЕФЗДгІШчЯТЃКNiO2ЃЋFeЃЋ2H2O![]() Fe(OH)2ЃЋNi(OH)2ЁЃ
Fe(OH)2ЃЋNi(OH)2ЁЃ
ЂйДЫаюЕчГидкГфЕчЪБЃЌЕчГиИКМЋгІгыЭтМгЕчдДЕФ___МЋСЌНгЃЌЕчМЋЗДгІЪНЮЊ__________ЁЃ
ЂкЗХЕчЪБЩњГЩNi(OH)2ЕФвЛМЋЃЌдкГфЕчЪБЗЂЩњ_______ЗДгІ(ЬюЁАбѕЛЏЁБЛђЁАЛЙдЁБ)
(2)АДШчЭМЫљЪОзАжУНјааЯТСаВЛЭЌЕФВйзї

ЂйНЋK1 ЁЂK2ЁЂ K3ЗжБ№жЛЙиБевЛИіЃЌдђЬњЕФИЏЪДЕФЫйЖШзюПьЕФЪЧжЛБеКЯ_____(ЬюЁАK1ЁБЛђ ЁАK2ЁБЛђЁАK3ЁБЃЌЯТЭЌ)ЃЌЮЊМѕЛКЬњЕФИЏЪДЃЌ жЛБеКЯ_____ЃЌИУЗРЛЄЗЈГЦЮЊ__________________________ЁЃ
ЂкжЛБеКЯK3ЃЌЕБЬњАєжЪСПМѕЩй5.6gЪБЃЌЪЏФЋЕчМЋЯћКФЕФЦјЬхЬхЛ§ЮЊ__________L(БъзМзДПі)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП25ЁцЪБЃЌFeSКЭZnSЕФБЅКЭШмвКжаЃЌН№ЪєбєРызггыS2-ЕФЮяжЪЕФСПХЈЖШЕФИКЖдЪ§ЙиЯЕШчЭМЫљЪОЁЃ ЯТСаЫЕЗЈе§ШЗЕФЪЧ

A.ШмНтЖШS(FeS)<S(ZnS)
B.aЕуБэЪОFeSЕФВЛБЅКЭШмвКЃЌЧвc(Fe2+)>c(S2Љ)
C.ЯђbЕуЖдгІШмвКжаМгШыNa2SШмвКЃЌПЩзЊЛЏЮЊcЕуЖдгІЕФШмвК
D.ЯђКЌгаFe2+КЭZn2+ЕФШмвКжаЕЮМгNa2SШмвКЃЌFeSЯШЮіГі
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЗДгІN2O4(g)![]() 2NO2(g) ІЄHЃН57kJЁЄmol-1ЃЌдкЮТЖШЮЊT1ЁЂT2ЪБЃЌЦНКтЬхЯЕжаNO2ЕФЬхЛ§ЗжЪ§ЫцбЙЧПБфЛЏЧњЯпШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
2NO2(g) ІЄHЃН57kJЁЄmol-1ЃЌдкЮТЖШЮЊT1ЁЂT2ЪБЃЌЦНКтЬхЯЕжаNO2ЕФЬхЛ§ЗжЪ§ЫцбЙЧПБфЛЏЧњЯпШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
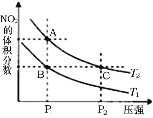
A.гЩзДЬЌBЕНзДЬЌAЃЌПЩвдгУМгШШЕФЗНЗЈ
B.AЁЂCСНЕуЦјЬхЕФбеЩЋЃКAЩюЃЌCЧГ
C.AЁЂCСНЕуЕФЗДгІЫйТЪЃКAЃОC
D.AЁЂCСНЕуЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПЃКAЃОC
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПДгКЃЫЎжаЬсШЁУОЃЌе§ШЗЕФЗНЗЈЪЧ( )
A.КЃЫЎ![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
B.КЃЫЎ![]() MgCl2ШмвК
MgCl2ШмвК![]() MgCl2ОЇЬх
MgCl2ОЇЬх![]() Mg
Mg
C.КЃЫЎ![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
D.КЃЫЎ![]() Mg(OH)2
Mg(OH)2![]() MgCl2ШмвК
MgCl2ШмвК![]() ЮоЫЎMgCl2
ЮоЫЎMgCl2![]() Mg
Mg
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчЭМЮЊЯђ25mL 0.1molЁЄL1NaOHШмвКжаж№ЕЮЕЮМг0.2molЁЄL1CH3COOHШмвКЙ§ГЬжаШмвКpHЕФБфЛЏЧњЯпЁЃЧыЛиД№ЃК
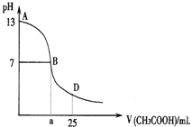
(1)BЕуШмвКГЪжаад,гаШЫОнДЫШЯЮЊ,дкBЕуЪБNaOHгыCH3COOHЧЁКУЭъШЋЗДгІ,етжжПДЗЈЪЧЗёе§ШЗ?(бЁЬюЁАЪЧЁБЛђЁАЗёЁБ)_________.ШєВЛе§ШЗ,дђЖўепЧЁКУЭъШЋЗДгІЕФЕуЪЧдкABЧјМфЛЙЪЧBDЧјМфФк?__________________(Шєе§ШЗ,ДЫЮЪВЛД№)
(2)ABЧјМф,c(OH)>c(H+),дђc(OH)гыc(CH3COO)ДѓаЁЙиЯЕЪЧ_______________
A.c(OH)вЛЖЈДѓгкc(CH3COO) B.c(OH)вЛЖЈаЁгкc(CH3COO)
C.c(OH)вЛЖЈЕШгкc(CH3COO) D.c(OH)ДѓгкЁЂаЁгкЛђЕШгкc(CH3COO)
(3)дкDЕуЪБ,ШмвКжаc(CH3COO)+c(CH3COOH)_________2c(Na+)(ЁА>ЁБЁЂЁА<ЁБЛђЁА=ЁБ)
(4)ГЃЮТЯТ,НЋVmLЁЂ0.1000molЁЄL1ЧтбѕЛЏФЦШмвКж№ЕЮМгШыЕН20.00mLЁЂ0.1000molЁЄL1ДзЫсШмвКжа,ГфЗжЗДгІЁЃЛиД№ЯТСаЮЪЬт.(КіТдШмвКЬхЛ§ЕФБфЛЏ)
ЂйШчЙћШмвКpH=7,ДЫЪБVЕФШЁжЕ____________20.00(ЬюЁА>ЁБЁЂЁА<ЁБЛђЁА=ЁБ),ЖјШмвКжаc(Na+)ЁЂc(CH3COO)ЁЂc(H+)ЁЂc(OH)ЕФДѓаЁЙиЯЕЮЊ________________________.
ЂкШчЙћV=40.00,дђДЫЪБШмвКжаc(OH)c(H+)c(CH3COOH)=__________________molЁЄL1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгаЛњИпЗжзгВФСЯMЕФНсЙЙМђЪНЮЊ ,ЯТЭМЪЧгЩгаЛњЮяA(ЗжзгЪНЮЊC5H8O)КЭБНМзШЉЮЊдСЯЩњВњИУгаЛњЮяЕФКЯГЩТЗЯпЁЃ
,ЯТЭМЪЧгЩгаЛњЮяA(ЗжзгЪНЮЊC5H8O)КЭБНМзШЉЮЊдСЯЩњВњИУгаЛњЮяЕФКЯГЩТЗЯпЁЃ

вбжЊ:ЂйAЗжзгжагаСНжжВЛЭЌЛЗОГЕФЧтдзг
ЂкCH3CH2CH![]() CH2
CH2![]() CH3CHBrCH
CH3CHBrCH![]() CH2
CH2
CH3CHO+CH3CHO![]()
![]()
![]()
![]() CH3CH
CH3CH![]() CHCHO+H2O
CHCHO+H2O
ЧыЛиД№вдЯТЮЪЬт:
(1)AЕФНсЙЙМђЪНЮЊ____,BЕФУћГЦЮЊ____,FжаЫљКЌЙйФмЭХЕФУћГЦЪЧ__________ЁЃ
(2)ЂйКЭЂлЕФЗДгІРраЭЗжБ№ЪЧ____ЁЂ____;ЗДгІЂкЕФЗДгІЬѕМўЮЊ_____________ЁЃ
(3)ЗДгІЂмЕФЛЏбЇЗНГЬЪНЮЊ_____________________________________________ЁЃ
(4)гаЛњЮяEгаЖржжЭЌЗжвьЙЙЬх,ЦфжаЭЌЪБЗћКЯЯТСаЬѕМўЕФЭЌЗжвьЙЙЬхга___жжЁЃ
ЂйЪєгкЗМЯуѕЅРрЁЁ ЂкЦфЫсадЫЎНтВњЮягіFeCl3ЯдзЯЩЋ
(5)вд1-БћДМКЭNBSЮЊдСЯПЩвджЦБИОлБћЯЉДМ(![]() )ЁЃЧыЩшМЦКЯГЩТЗЯп(ЦфЫћЮоЛњдСЯШЮбЁ)ВЂгУШчЯТЗНЪНБэЪО_____________________ЁЃ
)ЁЃЧыЩшМЦКЯГЩТЗЯп(ЦфЫћЮоЛњдСЯШЮбЁ)ВЂгУШчЯТЗНЪНБэЪО_____________________ЁЃ
A![]() BЁЁ
BЁЁ![]() ФПБъВњЮя
ФПБъВњЮя
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПМзЁЂввЁЂБћЁЂЖЁЪЧжабЇГЃМћЕФЮяжЪЃЌЦфжаМзЁЂввЁЂБћОљКЌгаЭЌвЛжждЊЫиЃЌдквЛЖЈЬѕМўЯТЕФзЊЛЏЙиЯЕШчЭМЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
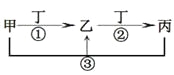
A.ШєЖЁЮЊгУСПзюДѓЃЌгУЭОзюЙуЕФН№ЪєЕЅжЪЃЌввЕФШмвКвЛЖЈЮЊFeCl3
B.ШєЭЈГЃЧщПіЯТМзЁЂввЁЂБћЁЂЖЁЖМЪЧЦјЬхЃЌЧвввКЭЖЁЮЊПеЦјЕФжївЊГЩЗжЃЌдђЗДгІЂйЕФЛЏбЇЗНГЬЪН4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
C.ШєМзЁЂввЁЂБћЕФШмвКЯдМюадЃЌБћПЩзїЮЊвНСЦЩЯжЮСЦЮИЫсЙ§ЖржЂЕФвЉМСЃЌНЋЕШЮяжЪЕФСПЕФввКЭБћШмгкЫЎаЮГЩЛьКЯШмвКЃЌШмвКжаИїРызгХЈЖШгЩДѓЕНаЁЕФЫГађЮЊc(NaЃЋ)>c(HCO3Ѓ)>c(CO32Ѓ)>c(OHЃ)> c(HЃЋ)
D.ШєЖЁЮЊЛЏКЯЮяЃЌЧвЮЊТШМюЙЄвЕЕФживЊВњЦЗЃЌдђМзвЛЖЈЮЊКЌAl3+ЕФбЮ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПАДеевЊЧѓЬюаДЯТСаФкШн ЃК
ЃЈ1ЃЉ1molH2ЕФжЪСПЪЧ_________ЁЃ
ЃЈ2ЃЉвбжЊ0.5molФГЦјЬхЗжзгЕФжЪСПЮЊ16 gЃЌдђИУЦјЬхЕФФІЖћжЪСПЪЧ_________ЁЃ
ЃЈ3ЃЉNAИіАБЦјЗжзгЃЈNH3ЃЉжаКЌ_________molдзгЁЃ
ЃЈ4ЃЉЕШжЪСПЕФбѕЦјКЭГєбѕЃЌЫќУЧдзгЕФИіЪ§жЎБШЮЊ_________ЁЃ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com