
| A. | m=1,n=5 | B. | m=4,n=3 | C. | m=3,n=4 | D. | m=4,n=5 |
分析 由1mol配合物生成1 mol AgCl沉淀,知道1mol配合物电离出1mol Cl-,即配离子显+1价,又因为外界有一个Cl-,且Co显+3价,所以[CoClm-1•nNH3]+中有两个氯原子,即m=3,又因为是正八面体,所以n=6-2=4.
解答 解::1mol此配合物与足量的AgNO3溶液反应只生成1mol AgCl沉淀,依据Ag++Cl-=AgCl↓可知,1mol此配合物电离产生1mol氯离子,即化学式中外界有1个氯离子,[CoClm-1•nNH3]+,Co显+3价,化合物中元素的化合价代数和为零,则内界有2个氯离子,即m=3,Co(Ⅲ)的八面体配合物具有6个配体,所以内界还有4个nNH3,即n=4,
所以m=3,n=4;
故选:C.
点评 本题主要考查了配合物的组成,电离时外界电离,内界不电离是解题的关键,题目难度不大.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3CHO+H2$\stackrel{Ni}{→}$CH3CH2OH | |
| B. | CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+2Ag↓+3NH3+H2O | |
| C. | CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O | |
| D. | 2CH3CHO+O2$\stackrel{△}{→}$2CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 服用阿司匹林过量出现水杨酸(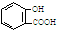 )中毒反应,可静脉注射NaHCO3溶液: )中毒反应,可静脉注射NaHCO3溶液: | |
| B. | 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| D. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二周期元素从C到F,非金属性逐渐减弱 | |
| B. | 第三周期元素从Na到Cl,原子半径逐渐增大 | |
| C. | HF、HCl、HBr、HI的沸点依次逐渐升高 | |
| D. | LiOH、NaOH、KOH的碱性依次逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,B
,B ,C
,C ,D
,D .它们离子的半径由大到小的顺序r(S2-)>r(Cl-)>r(K+)>r(Ca2+).
.它们离子的半径由大到小的顺序r(S2-)>r(Cl-)>r(K+)>r(Ca2+).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高正价依次升高 | |
| B. | 气态氢化物稳定性逐渐增强 | |
| C. | 原子半径逐渐增大 | |
| D. | 最高价氧化物对应的水化物碱性逐渐减弱,酸性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应容器内压强不随时间变化而变化 | |
| B. | 反应器内P、Q、R、S四种气体共存 | |
| C. | 生成P的速率与生成S的速率相等 | |
| D. | 生成1mol P必有1molQ生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅠA | B. | ⅡA | C. | ⅢA | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| m | n | ||
| x | y |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com