
| 元素代号 | A | B | C | D | E | G |
| 原子半径/nm | 0.089 | 0.071 | 0.117 | 0.16 | 0.074 | 0.082 |
| 主要化合价 | +2 | -1 | +4、-4 | +2 | -2 | +3 |
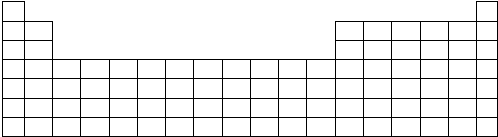
 ,
, ;
; ;
; ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(Cl-) |
| c(ClO-) |
A、参加反应的氯气的物质的量等于
| ||||||||
B、若某温度下,反应后
| ||||||||
C、改变温度,产物中KC1O3的最大理论产量为
| ||||||||
D、改变温度,反应中转移电子的物质的量ne的范围:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在食盐中添加适量的碘酸钾 |
| B、用甲醛浸泡食品,使其不易变质 |
| C、在食品加工中科学地使用食品添加剂 |
| D、研发高效低毒的农药,降低蔬菜的农药残留量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuCl2(CuO) |
| B、NaCl(HCl) |
| C、NaOH(NaOH) |
| D、CuSO4[Cu(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:
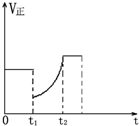 如图表示反应2SO2(g)+O2(g)═2SO3(g)△H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是( )
如图表示反应2SO2(g)+O2(g)═2SO3(g)△H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是( )| A、t1时减小了SO2 的浓度,增加了SO3的浓度,平衡向逆反应方向移动 |
| B、t1时降低了温度,平衡向正反应方向移动 |
| C、t1时减小了压强,平衡向逆反应方向移动 |
| D、t1时增加了SO2 和O2的浓度,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
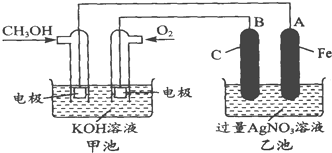
查看答案和解析>>
科目:高中化学 来源: 题型:
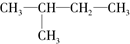 的叙述正确的是( )
的叙述正确的是( )| A、均能用CnH2n+2组成来表示 |
| B、与所有烷烃互为同素异形体 |
| C、因为它们结构相似,所以它们的化学性质相似,但物理性质不相同 |
| D、通常状况下它们都是气态烷烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L 该溶液中含硝酸钾 202g |
| B、100mL 该溶液中含硝酸钾0.02mol |
| C、从 1L该溶液中取出500 mL 后,剩余溶液的浓度为0.1mol/L |
| D、1L水中溶解0.2mol硝酸钾,即可配得 0.2mol/L硝酸钾溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com