
下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的能量多
B.由H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ·mol-1可知,若将含1molCH3COOH的稀溶液与含1molNaOH的稀溶液混合,放出的热量小于57.3kJ
C.由C(石墨)=C(金刚石)ΔH=1.9kJ·mol-1可知,金刚石比石墨稳定
D.已知2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1,则可知C的燃烧热ΔH=-110.5 kJ·mol-1
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
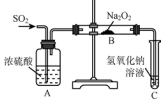 (1)已知Na2O2能与CO2反应,可用来呼吸面具中的做生氧剂.该反应:
(1)已知Na2O2能与CO2反应,可用来呼吸面具中的做生氧剂.该反应:查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上第一次教学诊断化学卷(解析版) 题型:实验题
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺如下(部分操作和条件略):
Ⅰ.将铬铁矿和碳酸钠混合在空气中充分焙烧。
Ⅱ.焙烧后的固体加水浸取,分离得到溶液A和固体A。
Ⅲ.向溶液A中加入醋酸调pH约7~8,分离得到溶液B和固体B。
Ⅳ.再向溶液B中继续加醋酸酸化,使溶液pH小于5。
Ⅴ.向上述溶液中加入氯化钾,得到重铬酸钾晶体。
(1)Ⅰ中焙烧发生的反应如下,配平并填写空缺:
① FeO•Cr2O3 + Na2CO3 + □ = Na2CrO4 + Fe2O3 + CO2↑
② Na2CO3+Al2O3=2NaAlO2+CO2↑
(2)固体A中主要含有 (填写化学式)。
(3)Ⅴ中发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,已知下表数据
物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
溶解度 (g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
40℃ | 40.1 | 36.4 | 26.3 | 215 | |
80℃ | 51.3 | 38 | 73 | 376 | |
获得K2Cr2O7晶体的操作由多步组成,依次是:加入KCl固体、 、过滤、洗涤、干燥得到晶体。洗涤沉淀的操作为 。
(4)Ⅲ中固体B中主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析固体B中氢氧化铝含量的方法是:称取n g样品,加入过量 (填写试剂名称)、溶解、过滤、再通入过量的CO2、灼烧、冷却、称量,得干燥固体m g。计算样品中氢氧化铝的质量分数为 (用含m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上10月月考化学试卷(解析版) 题型:实验题
请从图中选用必要的装置进行电解饱和食盐水(含酚酞)的实验,要求测定产生的氢气的体积(大于25mL),并检验氯气的氧化性。

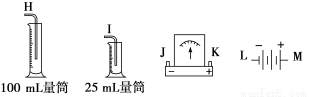
(1) A极发生的电极反应式是__________;B极发生的电极反应式是_______________
(2)电极A可能观察到的 现象是_________________
现象是_________________
(3)设计检测上述气体实验装置时,各接口的正确连接顺序为_______接_______、_______接A,B接_______、_______接_______。
(4)实验中,在盛有KI?淀粉溶液的容器中发生反应的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上10月月考化学试卷(解析版) 题型:选择题
某原电池总反应的离子方程式为2Fe3++Fe===3Fe2+,不能实现该反应的原电池是
A.正极为Cu,负极为Fe,电解质溶液为FeCl3
B.正极为C,负极为Fe,电解质溶液为Fe(NO3)3
C.正极为Fe,负极为Zn,电解质溶液为Fe2(S O4)3
O4)3
D.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上10月月考化学试卷(解析版) 题型:选择题
根据热化学方程式S(s)+O2(g)===SO2(g) ΔH=-297.23kJ·mol-1,分析下列说法中正确的是
①S(g)+O2(g)===SO2(g) ΔH=-Q,Q值大于297.23kJ·mol-1
②S(g)+O2(g)===SO2(g) ΔH=-Q,Q值小于297.23kJ·mol-1
③1molSO2的键能总和大于1molS与1molO2的键能总和
④1molSO2的键能总和小于1molS与1molO2的键能总和
A.①③ B.②④ C.①④ D.③④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学试卷(解析版) 题型:简答题
(1)对于下列反应:2SO2(g) + O2(g) 2SO3(g) , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用SO2浓度变化来表示的化学反应速率为____________,如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_________。
2SO3(g) , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用SO2浓度变化来表示的化学反应速率为____________,如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_________。
(2)下图表示在密闭容器中反应:2SO2+O2 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是________;b~c过程中改变的条件可能是_________; 若增大压强时,反应速度变化情况画在c~d处。
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是________;b~c过程中改变的条件可能是_________; 若增大压强时,反应速度变化情况画在c~d处。

(3)以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将___________(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时____________(填“增大”、“减小”或“相等”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学试卷(解析版) 题型:选择题
下列有关能量的叙述错误的是( )
A.化学反应均伴随着能量的变化
B.吸热反应中由于反应物总能量小于生成物总能量,因而没有利用价值
C.物质的化学能可以在一定条件下转化为热能、电能,为人类利用
D.需要加热才能发生的反应不一定是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com