
 用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升.根据实验现象判断下列说法错误的是( )
用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升.根据实验现象判断下列说法错误的是( )| A. | 实验中发生的反应都是化合反应 | B. | 铝是一种较活泼的金属 | ||
| C. | 铝与氧气反应放出大量的热量 | D. | 铝片上生成的白毛是氧化铝 |
分析 A、从铝的氧化以及铝与硝酸汞的反应进行分析判断;
B、依据铝的化学性质进行分析;
C、从红墨水的变化分析温度的变化即可;
D、从反应的发生判断产物的情况即可.
解答 解:A、铝在空气中易与氧气生成氧化铝,反应物是两种生成物是一种,是化合反应,铝与硝酸汞的反应是铝能置换出硝酸汞中的汞,反应物与生成物均是一种单质一种化合物,是置换反应,而不是化合反应,故A错误;
B、铝的化学性质比较活泼,不久铝箔表面生出“白毛”,可知该结论,故B正确;
C、红墨水柱右端上升说明试管内气压升高,可判断其温度升高,从而判断铝与氧气反应放出大量的热量,故C正确;
D、从铝的氧化以及铝与硝酸汞的反应可知铝片上生成的白毛是氧化铝,因为汞的化学性质不活泼,所以不可能是氧化汞,而是汞的单质的形式存在,故D正确;
故选A.
点评 此题是结合实验对铝与汞性质的考查,解题的关键是掌握性质与现象的关系,属基础性知识考查题.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
| 实验 编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测HCl溶液的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 臭氧具有氧化性,可用作自来水的消毒剂 | |
| B. | 活性炭具有还原性,可用作制糖业脱色剂 | |
| C. | 氢氟酸具有弱酸性,可用作玻璃的蚀刻剂 | |
| D. | 氨气具有弱碱性,可用作食品工业制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,将22.4LHCl溶于1L水,可配成1mol•L-l的稀盐酸 | |
| B. | 将100mL18mol•L-1的浓H2SO4和100mL水混合,可配成9moI•L-l的H2SO4溶液 | |
| C. | 将4.0gNaOH溶于100mL容量瓶中,加水至刻度线,配成1mol•L-1的NaOH溶液 | |
| D. | 将0.1molNaCl配成100mL溶液,从中取出10mL,所取出溶液的物质的量浓度为1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解过程中共转移0.4 mol电子 | B. | 原混合液中c(K+)为2.0 mol•L-l | ||
| C. | 电解得到的Cu的质量为6.4 g | D. | 电解后溶液中c(H+)为0.1 mol•L-l |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuO、Na2O和Na2O2都是碱性氧化物 | |
| B. | SO2能与碱反应生成盐和水,因此SO2属于酸性氧化物 | |
| C. | NH4Cl不含金属阳离子,不属于盐 | |
| D. | 金属氧化物都是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
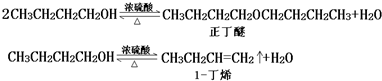
| 化合物 | 密度(g•cm-3) | 水溶性 | 沸点(℃) |
| 冰乙酸 | 1.05 | 易溶 | 118.1 |
| 正丁醇 | 0.80 | 微溶 | 117.2 |
| 正丁醚 | 0.77 | 不溶 | 142.0 |
| 乙酸正丁酯 | 0.90 | 微溶 | 126.5 |
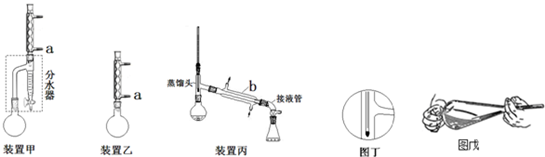

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com