
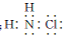 .
.分析 (1)根据化合价的代数和为0计算;NH2Cl是共价化合物,N、Cl原子周围8个电子;
(2)NH2Cl水解生成一水合氨和HClO;
(3)NCl3中Cl元素的化合价为+1价,反应生成Cl为-1价,结合物质的量计算;
(4)己知:①2NH3(g)+3C12(g)=N2(g)+6HCl(g)△H1=-469kJ/mol
②N2(g)+3C12(g)=2NC13(g)△H2=+520kJ/mol,根据盖斯定律,$\frac{1}{2}$(①+②)得到NH3(g)+3C12(g)=NC13(g)+3HCl(g)据此计算.
解答 解:(1)NH2Cl中N元素为-3价,H为+1价,则氯元素的化合价为+1价;NH2Cl是共价化合物,N、Cl原子周围8个电子,则其电子式为: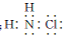 ;
;
故答案为:+1;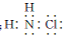 ;
;
(2)NH2Cl水解生成一水合氨和HClO,水解方程式为NH2Cl+2H2O?NH3•H2O+HClO;
故答案为:NH2Cl+2H2O?NH3•H2O+HClO;
(3)NCl3中Cl元素的化合价为+1价,反应生成Cl为-1价,0.01mol NCl3转移电子为0.06mol,100mL0.5mol/LNa2SO3溶液中Na2SO3为0.05mol,Na2SO3作还原剂能失去0.1mol电子,所以Na2SO3过量,按照NCl3计算转移电子为0.06mol;
故答案为:0.06mol;
(4)己知:①2NH3(g)+3C12(g)=N2(g)+6HCl(g)△H1=-469kJ/mol,
②N2(g)+3C12(g)=2NC13(g)△H2=+520kJ/mol,
根据盖斯定律,$\frac{1}{2}$(①+②)得到NH3(g)+3C12(g)=NC13(g)+3HCl(g),则△H3=$\frac{1}{2}$(-469kJ/mol++520kJ/mol)=+25.5kJ/mol;
故答案为:+25.5.
点评 本题考查氧化还原反应、盖斯定律的计算,为高频考点,把握反应中元素的化合价变化以及盖斯定律的内容为解答的关键,注意从化合价角度分析氧化还原反应,难度中等.


科目:高中化学 来源: 题型:选择题
 药物阿司匹林可由水杨酸制得,它们的结构如图所示,有关说法正确的( )
药物阿司匹林可由水杨酸制得,它们的结构如图所示,有关说法正确的( )| A. | 服用阿司匹林,身体出现水杨酸不良反应时,可静脉注射NaHCO3溶液 | |
| B. | 阿司匹林的分子式为C9H10O4 | |
| C. | 1mol阿司匹林最多可消耗2molNaOH | |
| D. | 水杨酸可以发生取代,加成,氧化,加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它的质量是32 g | B. | 约含有6.02×1023个O2分子 | ||
| C. | 含有2 mol O | D. | 红热的铁丝可在其中剧烈燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低温度 | |
| B. | 升高温度同时充入N2 | |
| C. | 增大压强 | |
| D. | 及时将 CO2和 N2 从反应体系中移走 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
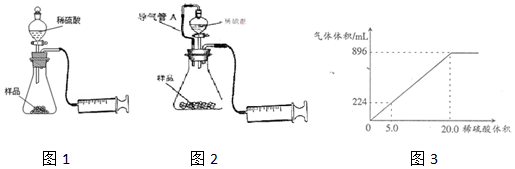
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
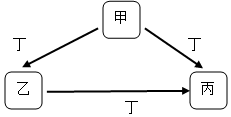 甲、乙、丙、丁均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去).
甲、乙、丙、丁均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com