
| 无机酸 | 氢氰酸(HCN) | 碳酸(H2CO3) | 氢氟酸(HF) |
| 电离平衡常数K值 | 6.2×10-10(K) | 4.2×10-7(K1) 5.6×10-11(K2) |
6.61×10-4(K) |
| A、氟化钠溶液中通入过量CO2 F-+H2O+CO2=HF+HCO3- |
| B、Na2CO3溶液中2C(Na+)=C(CO32-)+C(HCO3-)+C(H2CO3) |
| C、中和等体积、等pH的氢氰酸(HCN)和氢氟酸(HF)消耗NaOH的量前者大于后者 |
| D、等浓度的NaCN和NaF溶液中PH值前者小于后者 |


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
| A、0.1mol?L-1氨水,溶液的pH=13 |
| B、0.1mol?L-1氨水加水稀释,溶液中c(H+)和c(OH-)都减小 |
| C、0.1mol?L-1醋酸溶液中:c(H+)=c(CH3COO-) |
| D、0.1mol?L-1醋酸与0.1mol?L-1 NaOH溶液等体积混合所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X、Y形成的化合物中可能含有双键 |
| B、X单质和Z单质在暗处能剧烈反应 |
C、W元素与Z元素形成的化合物用电子式表示形成过程为: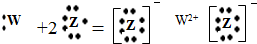 |
| D、XZ的沸点在与Z同族的其它X的化合物中最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 实验Ⅰ量取20.0mL的H2SO4待测液放入锥形瓶中 |
B、 实验Ⅱ用CaC2和饱和食盐水反应制取C2H2 |
C、 实验Ⅲ制取氨气 |
D、 实验Ⅳ褪色证明了乙烯可以与溴发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
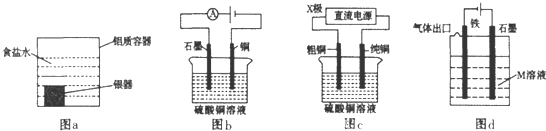
| A、利用图a装置处理银器表面的黑斑Ag2S,银器表面发生的反应为Ag2S+2e-=2Ag+S2- |
| B、图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出 |
| C、图c中的X极若为负极,则该装置可实现粗铜的精炼 |
| D、图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室常用无水硫酸铜作气体干燥剂 |
| B、工业上常用电解AlCl3,制备金属Al |
| C、CO2溶于水能导电,故CO2是电解质 |
| D、NH4Cl溶液中离子浓度大小关系为c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢镁溶液中加入过量的NaOH溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2H2O+2CO32- |
| B、NaHSO4溶液与Ba(OH)2溶液混合后显酸性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| C、少量Cl2通入水中:Cl2+H2O?2H++ClO-+Cl- |
| D、酸性高锰酸钾可使草酸溶液褪色:2MnO4-+5C2O42-+16H+=2Mn2++l0CO2↑+8H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com