

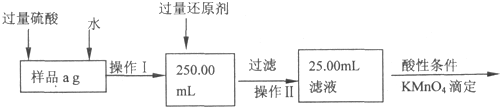
| 112 |
| 160 |
| ||
| a |
| 7(W2-W1) |
| a |
| 7(W2-W1) |
| a |
| 25.00 |
| 250.0 |
| 2.8bc |
| a |
| 2.8bc |
| a |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
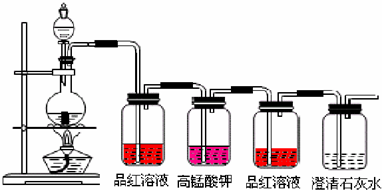
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验现象 | 结论 |
| ①取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 | ||
| ② |
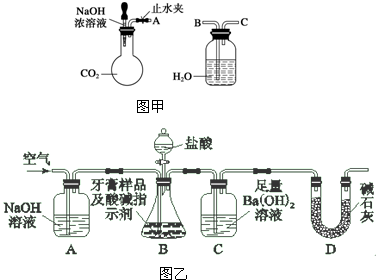
查看答案和解析>>
科目:高中化学 来源: 题型:
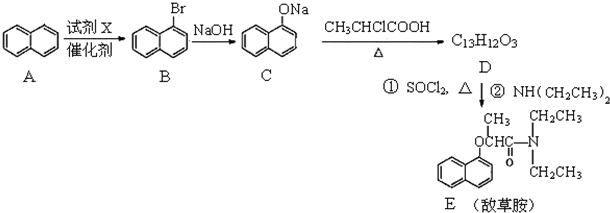
| PCI3 |
| △ |
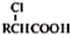 ,写出以苯酚、乙醇和乙酸为原料制备
,写出以苯酚、乙醇和乙酸为原料制备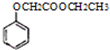 的合成路线流程图(无机试剂任用).合成路线流程图例如下:
的合成路线流程图(无机试剂任用).合成路线流程图例如下:| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① |
| ② |
 ,请写出设计合成实验时所涉及的有机反应类型:
,请写出设计合成实验时所涉及的有机反应类型:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、轮船水线以下的船壳上装一定数量的锌块 |
| B、铁可以在氯气中燃烧 |
| C、纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快 |
| D、镀锌的铁比镀锡的铁耐用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com