
| A、84g NaHCO3晶体中含有NA个CO32- |
| B、0.1mol?L-1K2CO3溶液中,阴离子总数大于0.1NA |
| C、1.8g石墨和C60的混合物中,碳原子数目为0.15NA |
| D、标准状况下,22.4L CCl4中含有的共用电子对数目为4NA |


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
 高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示.下列说法正确的是( )
高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示.下列说法正确的是( )| A、铁是阳极,电极反应为Fe-2e-+2OH-═Fe(OH)2 |
| B、电解一段时间后,镍电极附近溶液的pH减小 |
| C、若离子交换膜为阴离子交换膜,则电解过程中氢氧根向阳极移动 |
| D、每制得1mol Na2FeO4,理论上可以产生67.2L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | ||||
B、铜片接电源正极,碳棒接电源负极,电解硫酸铜溶液:Cu+2H+
| ||||
| C、在100mL浓度为1mol?L-1的Fe(NO3)3的溶液中通入足量SO2 2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | ||||
| D、实验室配制的亚铁盐溶液在空气中被氧化:4Fe2++O2+2H2O═4Fe3++4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述反应中,每消耗2mol NO2,就会生成22.4L N2O |
| B、CO2是氧化产物,且为H2CO3的酸酐 |
| C、等质量的N2O和CO2含有相等的电子数 |
| D、N2O会迅速与人体血红蛋白结合,使人中毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ | ⑤ | |
| 溶液 | 氨水 | 氢氧化钠 | 醋酸 | 盐酸 | 醋酸钠 |
| pH | 11 | 11 | 3 | 3 | 8.3 |
| A、表中五种溶液.其中①~④由水电离出的c(H+):②=④>①=③ |
| B、在⑤中加入适量④至溶液呈中性,所得溶液:c(Cl-)>c(Na+) |
| C、分别将①~④加水稀释至原溶液体积的100倍后溶液的pH:①>②>③>④ |
| D、将①、④两种溶液等体积混合所得溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去Cu2+(aq)中混有的少量Fe3+,可向其中通入过量的NH3 |
| B、在中和热测定的实验中,做三次平行实验最少要使用6次温度计 |
| C、FeCl3溶液与KSCN溶液混合,存在下述平衡:FeCl3+3KSCN?Fe(SCN)3+3KCl当达到平衡时,保持其他条件不变,可向其中加入固体KCl,来探究浓度对反应速率的影响 |
| D、常温下,用pH计测量等物质的量浓度的NaHC03和NaHS03溶液的pH,来探究H2CO3、H2SO3酸性的相对强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6句 | B、7句 | C、8句 | D、9句 |
查看答案和解析>>
科目:高中化学 来源: 题型:
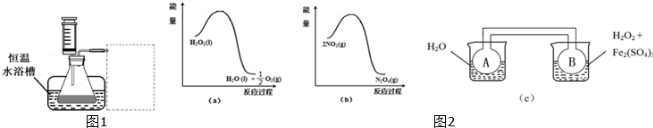
| 实验序号 物理量 | V[0.1mol?L-1 Fe2(SO4)3]/mL | … | |
| 1 | a | … | |
| 2 | a | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
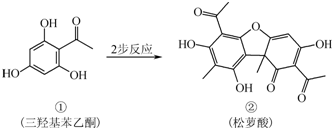
| A、有机物①的分子式为C8H8O4 |
| B、有机物②中含有1个手性碳原子 |
| C、检验②中是否含有杂质①,可用FeCl3溶液 |
| D、相同物质的量①、②与足量NaOH溶液反应,消耗NaOH的物质的量相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com