
下列说法正确的是
A.某物质经科学测定只含有一种元素,则可以断定该物质是一种纯净物
B.不能用瓷坩埚加热熔融氢氧化钠固体
C.将SO2通入品红溶液或溴水均能使它们褪色,证明SO2有漂白性
D.向某溶液中滴加氯水后,滴加KSCN溶液,溶液变红,证明溶液中含有Fe2+
科目:高中化学 来源:2015届山西省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列实验操作能达到预期实验目的的是
| 实验目的 | 实验操作 |
A | 鉴别CO32-和 SO42- | 分别加入饱和CaCl2溶液 |
B | 比较Al和Fe的金属活动性 | 分别加入浓NaOH溶液 |
C | 比较苯酚和乙酸的酸性 | 分别加入NOH溶液 |
D | 比较AgCl和AgI的溶解度 | 向AgCl的饱和液中加少量KI溶液 |
查看答案和解析>>
科目:高中化学 来源:2015届山东省邹城市高三10月月考化学试卷(解析版) 题型:选择题
已知: ①向KMnO4溶液中滴加浓盐酸,产生黄绿色气体; ②向KBr溶液中通入少量实验①产生的气体,溶液变黄色; ③取实验②生成的溶液少量滴在FeCl2与KSCN的混合溶液中,溶液变血红色。根据以上实验,下列判断正确的是
A.上述实验中,共有两个氧化还原反应
B.上述实验证明还原性:Fe2+>Br->Cl-> Mn2+
C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝
D.实验③证明Fe2+既有氧化性又有还原性
查看答案和解析>>
科目:高中化学 来源:2015届山东省菏泽市高三上学期期中联考化学试卷(A)(解析版) 题型:填空题
(8分)I、煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O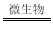 4H++2Fe2++4SO42-
4H++2Fe2++4SO42-
②Fe2++O2+H+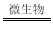 Fe3++____________;
Fe3++____________;
③FeS2+2Fe3+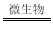 3Fe2++2S;
3Fe2++2S;
④2S+3O2+2H2O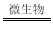 4H++2SO42-。
4H++2SO42-。
已知:FeS2中的硫元素为-1价。回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述②离子方程式配平并补充完整。
(2)反应③的还原剂是 。
(3)观察上述反应,硫元素最终转化为 从煤炭中分离出来。
II、工业上用黄铜矿( CuFeS2)冶炼铜,副产品中也有SO2 ,冶炼铜的反应为
8CuFeS2 + 21O2 8Cu + 4FeO + 2Fe2O3 + 16SO2
8Cu + 4FeO + 2Fe2O3 + 16SO2
若CuFeS2中 Fe 的化合价为+2 ,反应中被还原的元素是 (填元素符号)。当生成0.8 mol铜时,此反应转移的电子数目是 。
查看答案和解析>>
科目:高中化学 来源:2015届山东省菏泽市高三上学期期中联考化学试卷(A)(解析版) 题型:选择题
实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的
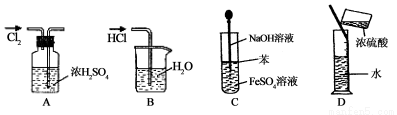
A.干燥Cl2 B.吸收HCl
C.制取Fe(OH)2沉淀 D.稀释浓H2SO4
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次质量检测化学试卷(解析版) 题型:实验题
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
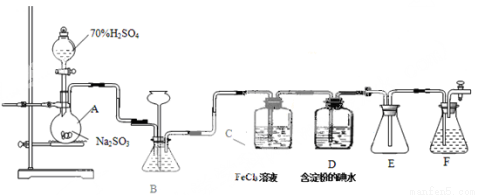
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若 ,则整个装置气密性良好。装置E的作用是 。装置F中为 溶液。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
A.蒸馏水 B.饱和Na2SO3溶液
C.饱和NaHSO3溶液 D.饱和NaHCO3溶液
(3)SO2气体还原Fe3+反应的产物是________________(填离子符号)。
(4)在上述装置中通入过量的SO2为了验证C中SO2与Fe3+发生了氧化还原反应,他们取C中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是____,原因是_______________________________________。
(5)能表明I-的还原性弱于SO2的现象是___________,写出有关离子方程式:______________。
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
高铁酸钠(Na2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强、无二次污染的绿色水处理剂。工业制高铁酸钠的方法有如下两种:
湿法制备的主要离子反应为:2Fe(OH)3 +3ClO—+4OH— =2FeO42— +3Cl— +5H2O ,
干法制备的主要反应方程为:2FeSO4 +6Na2O2 = 2Na2FeO4 +2Na2O +2Na2SO4 +O2↑
则下列有关说法不正确的是( )
A.高铁酸钠中铁显+6价
B.湿法中FeO42—是氧化产物
C.干法中每生成1mol Na2FeO4 转移4mol电子
D.K2FeO4可氧化水中的H2S、NH3,生成的Fe(OH)3胶体还能吸附悬浮杂质
查看答案和解析>>
科目:高中化学 来源:2015届山东省聊城市高三上学期第一次阶段性测试化学试卷(解析版) 题型:填空题
(12分)A、B、C、D是原子序数依次增大的短周期主族元素,A、C在元素周期表中的相对位置如图,A元素最外层与次外层上的电子数之差为3,B为地壳中含最最多的金属元素。
(1)D离子结构示意图为_____________。
(2)将C的低价态氧化物甲通入到D单质的水溶液会使之褪色,写出该反应的离子方程 式_______________。
(3)A的最高价氧化物对应的水化物是乙,现将过量Cu加入到100 mL 8.0 mol/L乙的浓溶液中,充分 反应,共收集到6.72L(标准状况)气体,则该气体的成分是_________,还原剂失电子数为_________________。
(4)将两份足量的B单质分别加入到等体积等浓度的盐酸和NaOH溶液中,充分反应生成气体的体积比为_________,若将反应后所得的溶液混合,会生成白色沉淀,发生反应的离子方程式为_________________;B单质表面的氧化膜可用NaOH溶液除去,写出该反应的化学方程式____________________ _。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com