
【题目】PMMA是一种具有较好的透明性、化学稳定性、易染色、易加工、外观优美的塑料,在建筑业中有着广泛应用,分子式是![]() 。一种从原料
。一种从原料![]() 合成PMMA的路线如图所示:
合成PMMA的路线如图所示:
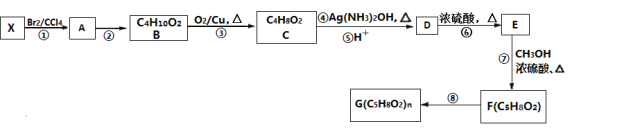
请回答:
(1)原料X的结构简式为________。
(2)②的反应类型是________。F中含有的官能团名称是________。
(3)写出④的化学方程式________。
(4)D的同分异构体中,能发生银镜反应、水解反应和酯化反应的同分异构体有________种。
(5)已知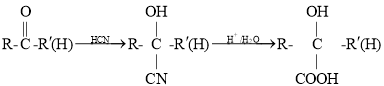 (其中R、
(其中R、![]() 均代表烃基)。若以丙烯为原料,利用上述信息设计合成中间体D,在得到D的同时也得到了另一种有机副产物M,则M可能的结构简式是________。
均代表烃基)。若以丙烯为原料,利用上述信息设计合成中间体D,在得到D的同时也得到了另一种有机副产物M,则M可能的结构简式是________。
【答案】CH2=C(CH3)2 取代反应或水解反应 酯基、碳碳双键 (CH3)2C(OH)CHO+2Ag(NH3)2OH![]() (CH3)2C(OH)COONH4+2Ag↓+3NH3+H2O 5 CH3CH2CH(OH)COOH
(CH3)2C(OH)COONH4+2Ag↓+3NH3+H2O 5 CH3CH2CH(OH)COOH
【解析】
根据F与G的分子式可知, F发生加聚反应生成G,F为G的单体,结合合成路线中的信息可知,F中含有碳碳双键,由E与甲醇在浓硫酸催化下发生酯化反应生成F,根据分子式可知,E的分子式为C4H6O2,D在浓硫酸催化下发生消去反应生成E,根据逆推法可知,D为(CH3)2C(OH)COOH,E为CH2=C(CH3)COOH,F为CH2=C(CH3)COOCH3,则C为(CH3)2C(OH)CHO,B为(CH3)2C(OH)CH2OH,A为(CH3)2CBrCH2Br,X的分子式为C4H8,能与溴的四氯化碳发生反应,则X为烯烃,X为CH2=C(CH3)2,据此分析。
根据F与G的分子式可知, F发生加聚反应生成G,F为G的单体,结合合成路线中的信息可知,F中含有碳碳双键,由E与甲醇在浓硫酸催化下发生酯化反应生成F,根据分子式可知,E的分子式为C4H6O2,D在浓硫酸催化下发生消去反应生成E,根据逆推法可知,D为(CH3)2C(OH)COOH,E为CH2=C(CH3)COOH,F为CH2=C(CH3)COOCH3,则C为(CH3)2C(OH)CHO,B为(CH3)2C(OH)CH2OH,A为(CH3)2CBrCH2Br,X的分子式为C4H8,能与溴的四氯化碳发生反应,则X为烯烃,X为CH2=C(CH3)2。
(1)原料X的结构简式为CH2=C(CH3)2;
(2)②是(CH3)2CBrCH2Br在氢氧化钠的水溶液中发生水解反应,也属于消去反应生成(CH3)2C(OH)CH2OH、溴化钠和水,反应类型是取代反应或水解反应;F为CH2=C(CH3)COOCH3,含有的官能团名称是酯基和碳碳双键;
(3)反应④是(CH3)2C(OH)CHO在银氨溶液中反应生成(CH3)2C(OH)COONH4、银、氨气和水,反应的化学方程式为(CH3)2C(OH)CHO+2Ag(NH3)2OH![]() (CH3)2C(OH)COONH4+2Ag↓+3NH3+H2O;
(CH3)2C(OH)COONH4+2Ag↓+3NH3+H2O;
(4)D为(CH3)2C(OH)COOH,其同分异构体中,能发生银镜反应、水解反应和酯化反应的同分异构体有HCOOCH(OH)CH2CH3、HCOOCH2CH(OH) CH3、HCOOCH2CH2CH2OH、HCOOCH(OH)(CH3)2、HCOOCH(CH3)CH2OH共5种;
(5)已知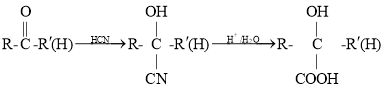 (其中R、
(其中R、![]() 均代表烃基)。若以丙烯为原料,利用上述信息设计合成中间体D,过程中生成C为CH3COCHO,CH3COCHO在得到D的同时也得到了另一种有机副产物M,则M可能的结构简式是CH3CH2CH(OH)COOH。
均代表烃基)。若以丙烯为原料,利用上述信息设计合成中间体D,过程中生成C为CH3COCHO,CH3COCHO在得到D的同时也得到了另一种有机副产物M,则M可能的结构简式是CH3CH2CH(OH)COOH。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:乙二酸(HOOC—COOH,可简写为H2C2O4),俗称草酸,157℃时开始分解。
(1)探究草酸的酸性
25℃ H2C2O4 K1=5.4×10-2,K2=5.4×10-5;H2CO3 K1=4.5×10-7,K2=4.7×10-11
下列化学方程式可能正确的是___。
A.H2C2O4+![]() =
=![]() +
+![]() B.
B.![]() +
+![]() =
=![]() +
+![]()
C.2![]() +CO2+H2O=2
+CO2+H2O=2![]() +
+![]() D.H2C2O4+
D.H2C2O4+![]() =
=![]() +H2O+CO2↑
+H2O+CO2↑
(2)探究草酸分解产物
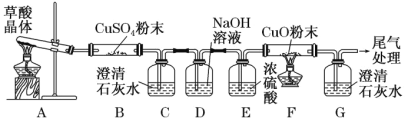
实验中观察到 B 中 CuSO4 粉末变蓝,C 中澄清石灰水变浑浊,D 的作用是 ___, 证明有 CO 气体生成的现象是______。
(3)探究催化剂对化学反应速率的影响
在甲、乙两支试管中各加入 4 mL 0.01 mol·L-1 酸性 KMnO4 溶液和 2 mL 0.1 mol·L-1H2C2O4 溶液,再向乙试管中加入一粒黄豆大的 MnSO4 固体,摇匀。填写表格:
反应现象 | ①_______ |
实验结论 | ②______ |
试管中发生反应的离子方程式 | ③______ |
(4)用酸性 KMnO4 溶液滴定 Na2C2O4,求算 Na2C2O4 的纯度。
实验步骤:准确称取 2.0 g Na2C2O4 固体,配成 100 mL 溶液;取出 20.00 mL 于锥形瓶
①KMnO4 溶液应装在_________ 滴定管中。(填“酸式”或“碱式”)
②Na2C2O4 的纯度是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是最常见的二次电池,电池总反应式为:Pb+PbO2+4H++2SO![]()
![]() 2PbSO4+2H2O,下列说法错误的是( )
2PbSO4+2H2O,下列说法错误的是( )
A.充电时,阴极反应式为:SO![]() +4H++PbO2+2e﹣═PbSO4+2H2O
+4H++PbO2+2e﹣═PbSO4+2H2O
B.充电时,两个电极的质量均减轻
C.电池放电时,电解质溶液的pH增大
D.电池放电时,负极可能会发生副反应:Pb+H2SO4═PbSO4+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用甲苯合成苯甲醛的一种合成路线如下图所示。下列说法中正确的是( )
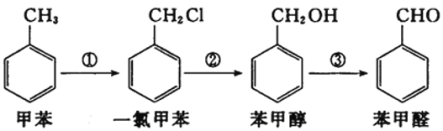
A.甲苯的一氯取代物有5种B.苯甲醇与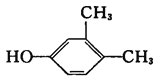 互为同系物
互为同系物
C.苯甲醛既有氧化性又有还原性D.①②③的反应类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸锌{M[Zn(C6H11O7)2]=455g·mol-1)是一种重要的补锌试剂,其在医药、食品、饲料、化妆品等领城中具有广泛的应用。纯净的葡葡糖酸锌为白色晶体,可溶于水,极易溶于热水,不溶于乙醇,化学兴趣小组欲在实验室制备葡萄糖酸锌并测定产率。实验操作分以下两步:
Ⅰ.葡萄糖酸(C6H12O7)的制备。量取50 mL蒸馏水于100 mL烧杯中,搅拌下缓慢加入2.7 mL(0.05 mol)浓H2SO4,分批加入21.5 g葡萄糖酸钙{M[Ca(C6H11O7)2]=430g·mol-1,易溶于热水},在90℃条件下,不断搅拌,反应40min后,趁热过滤。滤液转移至小烧杯,冷却后,缓慢通过强酸性阳离子交换树脂,交换液收集在烧杯中,得到无色的葡葡糖酸溶液。
Ⅱ.葡萄糖酸锌的制备。向上述制得的葡萄糖酸溶液中分批加入足量的ZnO,在60℃条件下,不断搅拌,反应1h,此时溶液pH≈6。趁热减压过滤,冷却结晶,同时加入10 mL 95%乙醇,经过一系列操作,得到白色晶体,经干燥后称量晶体的质量为18.2g。
回答下列问题:
(1)制备葡萄糖酸的化学方程式为________________。
(2)通过强酸性阳离子交换树脂的目的是_______________。
(3)检验葡萄糖酸溶液中是否存在SO42-的操作为_________。
(4)制备葡萄糖酸时选用的最佳加热方式为_______________。
(5)制备葡萄糖酸锌时加入乙醇的目的是________,“一系列操作”具体是指_______。
(6)葡萄糖酸锌的产率为______(用百分数表示),若pH≈5时就进行后续操作,产率将_____(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胆矾CuSO4·5H2O可写为[Cu(H2O)4]SO4·H2O,其结构示意图如下:
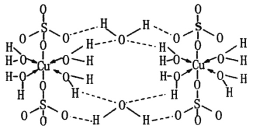
下列有关胆矾的说法正确的是
A.Cu2+的价电子排布式为3d84s1
B.所有氧原子都采取sp3杂化
C.胆矾中含有的粒子间作用力有离子键、极性键、配位键和氢键
D.胆矾所含元素中,H、O、S的半径及电负性依次增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方案设计能达到实验目的的是
A | B | C | D |
检验淀粉是否水解 | 由褪色快慢研究反应物浓度对反应速率的影响 | 证明发生了取代反应 | 验证Ksp[Cu(OH)2]<Ksp[Mg(OH)2 ] |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二草酸合铜(Ⅱ)酸钾晶体{K2[Cu(C2O4)2]2H2O}(摩尔质量为354gmol-1),是一种工业用化工原料。微溶于冷水和酒精,虽可溶于热水但会慢慢分解,干燥时较为稳定,温度高于260℃易分解。实验室以胆矾和草酸为原料制备二草酸合铜(Ⅱ)酸钾晶体的流程如下,请根据相关流程回答:(已知:H2C2O4![]() CO↑+CO2↑+H2O)
CO↑+CO2↑+H2O)
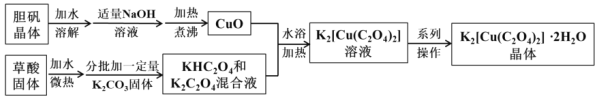
(1)抽滤CuO时若发现滤液中有较多浑浊,应采取的措施是_________。
(2)如图装置,经过一系列操作完成CuO的抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):开抽气泵→a→b→d→________→c→关抽气泵。
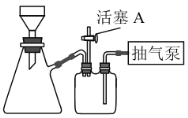
a.转移固液混合物; b.关活塞A; c.开活塞A; d.确认抽干; e.加洗涤剂洗涤
(3)KHC2O4和K2C2O4混合溶液制备时K2CO3固体需分批加入的原因是________。
(4)下列说法正确的是________。
A.从K2[Cu(C2O4)2]溶液中结晶时应采用水浴蒸发浓缩、冷却结晶
B.洗涤CuO沉淀和K2[Cu(C2O4)2]2H2O晶体时可分别用热水和冷水
C.为充分利用滤纸上的CuO,可将滤纸剪碎后加入到热的KHC2O4和K2C2O4混合溶液中,待充分反应后趁热过滤
D.在500℃下烘干K2[Cu(C2O4)2]2H2O晶体比200℃的效果更好
(5)产品纯度的测定:准确称取制得的晶体试样ag溶于氨水中,并加水定容至250mL,取试样溶液25.00mL,再加入10mL的稀硫酸,用bmolL-1的KMnO4标准液滴定,消耗KMnO4标准液V mL。
已知:![]()
①滴定过程中若不慎将标准液滴在锥形瓶内壁上,用少量蒸馏水冲洗锥形瓶内壁后再继续滴定至终点,实验结果会________。(填“偏大”“偏小”或“无影响”)
②该产品的纯度为________________。(用含字母的最简式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.凡是放热反应均能自发进行
B.N2(g)+3H2(g)![]() 2NH3(g) Δ H<0,当升高温度,该反应的 v(正)减小、v(逆)增大
2NH3(g) Δ H<0,当升高温度,该反应的 v(正)减小、v(逆)增大
C.钠投入水中,熔化成小球,说明钠和水的反应,反应物的总能量大于生成物的总能量
D.中和热测定时环形玻璃搅拌棒要不断顺时针搅拌,目的是为了混合均匀,充分反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com