
| A. | 为放热反应 | |
| B. | 为吸热反应 | |
| C. | 反应过程中热能转化为化学能 | |
| D. | 反应物的总能量低于生成物的总能量 |
科目:高中化学 来源: 题型:解答题

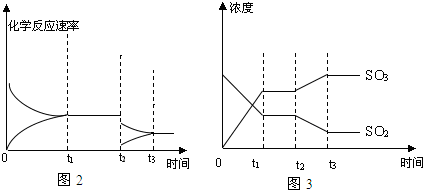
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有止血作用,特别对内脏的止血效果较好.
有止血作用,特别对内脏的止血效果较好. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.154 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其他 | 阳离子核 外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于50 mL | B. | 大于50 mL | C. | 等于100 mL | D. | 大于100 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用电子式表示溴化氢的形成过程为: | |
| B. | 海水中Br-的电子式为: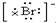 | |
| C. | 海水中通入氯气时发生反应的离子方程式为:2NaBr+Cl2=Br2+2NaCl | |
| D. | 氯离子的结构示意图为: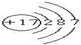 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com