
海洋是一座巨大的宝藏,海水中蕴含80多种元素。氯碱工业和制备金属镁的原料都来自于海水。
Ⅰ.在氯碱工业中,曾用石棉隔膜电解槽来电解食盐水(如图甲所示)。
(1)写出阳极的反应式: 。
(2)图甲中流出的b是 溶液。
(3)石棉隔膜的作用是 。
Ⅱ.随着科技的发展,电解工艺不断革新,电解效率和产品纯度得到提高。20世纪80年代起,隔膜法电解工艺逐渐被离子交换膜电解技术取代。
(1)离子交换膜电解槽(如图乙所示)中⑥、⑦分别是 、 。
(2)已知一个电子的电量是1.602×10-19C,用离子膜电解槽电解饱和食盐水,当电路中通过1.929×105 C的电量时,生成NaOH g。
Ⅲ.下图是工业上生产镁的流程。
(1)写出下列反应的化学方程式:
①沉淀池: ②电 解:
(2)整个生产流程中循环使用的物质是 。
(3)简述加热氯化镁的结晶水合物使之脱水转化为无水氯化镁的注意事项: 。
(15分)
Ⅰ.(1)2Cl--2e-=Cl2↑ (1分)
(2)NaOH和NaCl (1分)
(3)阻止气体通过 (2分)
Ⅱ.(1)NaOH溶液(1分) Na+(1分) (2)80(2分)
Ⅲ.(1)①MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2(2分)
②MgCl2(熔融) Mg+Cl2↑(2分)
Mg+Cl2↑(2分)
(2)氯气(1分)
(3)为了防止氯化镁水解,要在氯化氢气体的氛围中加热(2分)
解析试题分析:Ⅰ.(1)氯碱工业中阳极是氯离子放电生成氯气,电解反应式为2Cl--2e-=Cl2↑
(2)氯碱工业额产物除氯气、氢气外还有氢氧化钠,所以从b流出的液体为NaOH,还有未电解的NaCl;
(3)石棉隔膜的作用是防止气体通过,避免气体混合发生爆炸;
Ⅱ.(1)从图中判断离子交换膜是阳离子交换膜,允许阳离子通过,氢氧根离子不能通过留在阴极室,钠离子可以通过到达阴极室,所以⑥、⑦分别是NaOH溶液、Na+;
(2)电路中通过1.929×105 C的电量时,通过计算可知通过的电子的物质的量是2mol,由电解饱和食盐水的化学方程式知2e-~2NaOH,所以生成的NaOH的质量为80g;
Ⅲ.(1)①石灰乳是氢氧化钙的浊液,与海水中的氯化镁反应生成氢氧化镁沉淀,化学方程式为MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2 ②电解熔融的氯化镁可得镁,化学方程式为MgCl2(熔融) Mg+Cl2↑;
Mg+Cl2↑;
(2)过滤得到的氢氧化镁用盐酸中和,生成的氯气可用于制盐酸,所以整个生产流程中循环使用的物质是氯气;
(3)氯化镁水解生成氢氧化镁和氯化氢,加热促进水解,最终的氧化镁,所以为了防止氯化镁水解,要在氯化氢气体的氛围中加热。
考点:考查海水的综合利用,氯碱工业的不同装置的分析,电解反应式的书写及计算,单质镁的制取


科目:高中化学 来源: 题型:填空题
(1)如下图所示,组成一种原电池.试回答下列问题(灯泡功率合适):
①电解质溶液为稀H2SO4时上述装置中灯泡亮,此时Al电极上发生反应的电极反应式为: ___;
②电解质溶液为NaOH溶液时,灯泡______(填“亮”或“不亮”, 填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,则Mg电极上发生的电极反应式为:_______________;
Al电极上发生反应的电极反应式为:_______________;
b.若灯泡不亮,其理由为:________________________。
(2)原电池原理的应用之一是可以设计原电池。请利用反应“Cu+2Fe3+ =2Fe2+ +Cu2+ ”设制一个原电池(正极材料用碳棒)则该电池的负极材料是__________,若导线上转移电子1.5 mol,则溶解铜的质量是__________。另外的重要应用是实验室在用锌与稀硫酸反应制备氢气时,可向溶液中滴加少量硫酸铜溶液。其作用是: ______________________________。
(3)氢氧燃料电池(电解质为KOH溶液,惰性材料作电极)负极反应的电极反应式为:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
图为相互串联的甲、乙两电解池.试回答:
(1)若甲电解池利用电解原理在铁上镀银,则A是 (填电极材料),电极反应式 ;B(要求同A)是 ,电极反应式 ;应选用的电解质溶液是 。
(2)乙电解池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈 ,C极附近呈 。
(3)若甲电解池阴极增重4.32g,则乙槽中阳极上放出的气体在标准状况下的体积是 。
(4)若乙电解池中剩余溶液仍为400mL,则电解后所得溶液中新生成溶质的物质的量浓度为 mol?L-1,溶液的pH等于 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子(O2+4e-―→2O2-)。
(1)c电极的名称为 ,d电极上的电极反应式为 。
(2)如图2所示用惰性电极电解100 mL 0.5 mol·L-1CuSO4溶液,a电极上的电极反应式为 ,若a电极产生56 mL(标准状况)气体,则所得溶液的pH= (不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入 (填序号)。
a.CuO b.Cu(OH)2
c.CuCO3 d.Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
能量之间可相互转化:
(1)电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
①完成原电池甲的装置示意图(见上图),并作相应标注,要求:在同一烧杯中,电极与溶液含相同的金属元素。
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极__________。
③甲乙两种原电池可更有效地将化学能转化为电能的是________,其原因是______________________________。
(2)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(1)的材料中应选__________作阳极。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
O3可由臭氧发生器(原理如图)电解稀硫酸制得。
(1)图中阴极为 (填“A”或“B”),其电极反应式为 。
(2)若C处通入O2,则A极的电极反应式为 。
(3)若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况),则E处收集的气体中O3所占的体积分数为 (忽略O3的分解)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图为持续电解含有一定量CaCl2水溶液(含酚酞)的装置(以铂为电极),A为电流表。电解一段时间t1后,将CO2连续通入电解液中。
(1)电解时,F极发生 反应,电极反应为 ,E极发生 反应,电极反应为 ,电解总反应为 。
(2)电解池中产生的现象:
① _____________________
② _____________________
③ _____________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图所示装置模拟工业制取并收集ClO2。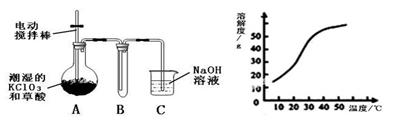
(1)A必须添加温度控制装置,除酒精灯、温度计外,还需要的玻璃仪器有 。
(2)反应后在装置C中可得NaClO2溶液。已知在温度低于38℃时NaClO2饱和溶液中析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据上右图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤: ① 蒸发结晶;② ;③ 洗涤;④ 干燥。
(3)ClO2很不稳定,需随用随制,用水吸收得到ClO2溶液。为测定所得溶液中ClO2的浓度,进行了下列实验:① 准确量取ClO2溶液V1mL加入到锥形瓶中,加适量蒸馏水稀释,调节试样的pH≤2.0。② 加入足量的KI晶体,静置片刻。此时发生反应的离子方程式为: ;③ 加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定,至终点时消耗Na2S2O3溶液V2 mL。则原ClO2溶液的浓度为 mol/L(用含字母的代数式表示)。(已知2 Na2S2O3+I2= Na2S4O6+2NaI)
Ⅱ.将由Na+、Ba2+、Cu2+、SO42-、Cl- 组合形成的三种强电解质溶液,分别装入下图装置
中的甲、乙、丙三个烧杯中进行电解,电极均为石墨电极。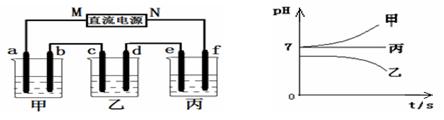
接通电源,经过一段时间后,测得乙中c电极质量增加。常温下各烧杯中溶液pH与电解时间t的关系如右上图(忽略因气体溶解带来的影响)。据此回答下列问题:
(1)写出乙烧杯中发生反应的化学方程式 ;
(2)电极f上发生的电极反应为 ;
(3)若经过一段时间后,测得乙烧杯中c电极质量增加了8g,要使丙烧杯中溶液恢复到原来的状态,应进行的操作是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【实验目的】利用所学知识,设计电池装置。
【实验用品】电极:镁条、铜片、铁片等。
【电解质】果汁(橙汁、苹果汁、柠檬汁等)。
【其他】导线、金属夹、发光二极管、500 mL烧杯。
【实验方案】①Cu—Mg原电池,电解质溶液为橙汁;
②Cu—Fe原电池,电解质溶液为苹果汁;
③Fe—Mg原电池,电解质溶液为柠檬汁。
【实验操作】用导线分别将三种方案中的金属片连接到金属夹上,分别将金属片两两插入到盛有果汁的三个500 mL的烧杯中,用发光二极管两端分别接触三种方案中金属活动性不同的金属夹。观察现象,连接方式如图所示。
【实验现象】三种方案中发光二极管均发光。
【实验结论】原电池把化学能转变为电能。
回答问题:
(1)连接装置时活泼金属接二极管的________极上,较不活泼金属接二极管的________极上。
(2)在方案①②中铜作电极情况__________________________。
(3)在方案①③中镁作电极情况__________________________。
(4)在方案②③中铁作电极情况__________________________。
(5)在方案③中负极反应为______,正极反应为________,总方程式为__________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com