
由两种金属组成的混合物8g,加入足量稀硫酸,放出5.6L气体(标准状况),则该混合物可能是
A.Al和Zn B.Zn和Fe C.Zn和Cu D.Al和Mg
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
 (2012?洛阳二模)如图所示,A、G、I均为单质,其中A、G为金属且都常被用作输电导线材料,B为黑色粉末,L是由两种元素组成的盐,它是家庭厨房必备物品.请回答:
(2012?洛阳二模)如图所示,A、G、I均为单质,其中A、G为金属且都常被用作输电导线材料,B为黑色粉末,L是由两种元素组成的盐,它是家庭厨房必备物品.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:



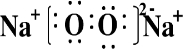
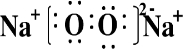
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2012?长宁区二模)短周期中常见金属X、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用).根据题意完成下列填空:
(2012?长宁区二模)短周期中常见金属X、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用).根据题意完成下列填空:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
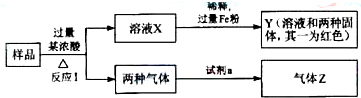
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:推断题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com