
 )和某合成鞣剂(
)和某合成鞣剂( 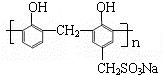 )
)
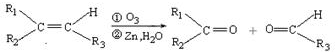 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)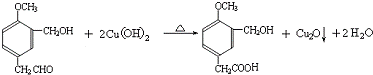 .
. .
.
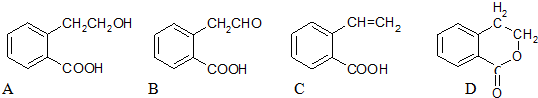
 ,写出 X可能的结构简式为
,写出 X可能的结构简式为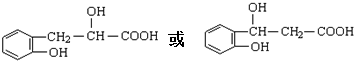 .
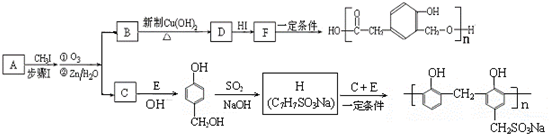
. 分析 有机物A的相对分子质量为164,8.2g有机物A的物质的量=$\frac{8.2g}{164g/mol}$=0.05mol,完全燃烧生成标准状况下11.2LCO2和5.4gH2O,则二氧化碳为$\frac{11.2L}{22.4L/mol}$=0.5mol,水为$\frac{5.4g}{18g/mol}$=0.3mol,则有机物A中N(C)=$\frac{0.5mol}{0.05mol}$=10、N(H)=$\frac{0.3mol×2}{0.05mol}$=12,则N(O)=$\frac{164-10×12-12}{16}$=2,故则A的分子式是C10H12O2.
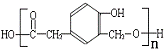
F在一定条件下合成高分子树脂(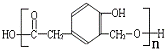 ),应是发生酯化反应,故F为
),应是发生酯化反应,故F为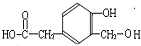 ,A发生信息反应生成B、C,B能被新制氢氧化铜氧化生成D,则B含有-CHO、D含有-COOH,D发生信息Ⅱ中第二步反应生成F,则D含有-OCH3,结合F的结构可知,D为
,A发生信息反应生成B、C,B能被新制氢氧化铜氧化生成D,则B含有-CHO、D含有-COOH,D发生信息Ⅱ中第二步反应生成F,则D含有-OCH3,结合F的结构可知,D为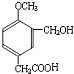 ,则B为
,则B为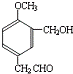 .有机物E溶液滴到饱和溴水中,有大量白色沉淀生成,则E含有酚羟基,结合C与E反应产物结构、H与C、E反应产物结构可知,C为HCHO、E为
.有机物E溶液滴到饱和溴水中,有大量白色沉淀生成,则E含有酚羟基,结合C与E反应产物结构、H与C、E反应产物结构可知,C为HCHO、E为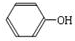 ,综上所述,A的结构为
,综上所述,A的结构为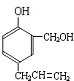 ,据此解答.
,据此解答.
解答 解:有机物A的相对分子质量为164,8.2g有机物A的物质的量=$\frac{8.2g}{164g/mol}$=0.05mol,完全燃烧生成标准状况下11.2LCO2和5.4gH2O,则二氧化碳为$\frac{11.2L}{22.4L/mol}$=0.5mol,水为$\frac{5.4g}{18g/mol}$=0.3mol,则有机物A中N(C)=$\frac{0.5mol}{0.05mol}$=10、N(H)=$\frac{0.3mol×2}{0.05mol}$=12,则N(O)=$\frac{164-10×12-12}{16}$=2,故则A的分子式是C10H12O2.
F在一定条件下合成高分子树脂( ),应是发生酯化反应,故F为
),应是发生酯化反应,故F为 ,A发生信息反应生成B、C,B能被新制氢氧化铜氧化生成D,则B含有-CHO、D含有-COOH,D发生信息Ⅱ中第二步反应生成F,则D含有-OCH3,结合F的结构可知,D为
,A发生信息反应生成B、C,B能被新制氢氧化铜氧化生成D,则B含有-CHO、D含有-COOH,D发生信息Ⅱ中第二步反应生成F,则D含有-OCH3,结合F的结构可知,D为 ,则B为
,则B为 .有机物E溶液滴到饱和溴水中,有大量白色沉淀生成,则E含有酚羟基,结合C与E反应产物结构、H与C、E反应产物结构可知,C为HCHO、E为
.有机物E溶液滴到饱和溴水中,有大量白色沉淀生成,则E含有酚羟基,结合C与E反应产物结构、H与C、E反应产物结构可知,C为HCHO、E为 ,综上所述,A的结构为
,综上所述,A的结构为 ,
,
(1)由上述分析可知,A的分子式为:C10H12O2,故答案为:C10H12O2;
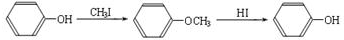
(2)反应中将醛基氧化为羧基,也可以氧化酚羟基,反应开始酚羟基发生反应,将醛基氧化为羧基后,D到F又产生酚羟基,故步骤Ⅰ的目的是保护酚羟基,
故答案为:保护酚羟基;
(3)E是苯酚,含氧官能团的名称是羟基,由物质结构可知,H→合成鞣剂的反应中除生成高聚物外,还原小分子物质生成,属于缩聚反应,
故答案为:羟基;缩聚反应;
(4)B→D的化学方程式是 ,
,
故答案为: ;
;
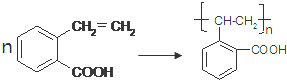
(5)F→高分子树脂的化学方程式是 ,
,
故答案为: ;
;
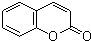
(6)F的同分异构体X具有如下特点:与F具有相同的官能团,1mol X 最多消耗Na、NaOH、NaHCO3的物质的量分别为3、2、1,则X中含有1个-COOH、1个酚羟基、1个醇羟基,苯环上有两个取代基,则侧链为-OH、-CH2CH(OH)COOH或-CH(OH)CH2COOH,结合香豆素的结构简式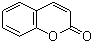 ,可知X中两个取代基处于邻位位置,故X的结构简式为
,可知X中两个取代基处于邻位位置,故X的结构简式为 ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,侧重考查学生分析推断及获取信息解答问题能力,需要学生对给予的信息进行利用,为高频考点,注意根据有机物的结构结合反应信息通过顺推法与逆推法相结合进行推断,知道常见有机物结构和性质,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NH4+、Fe2+、Cl-、SO42- | B. | Na+、K+、Cl-、SO42- | ||
| C. | Mg2+、AlO2-、Cl-、SO42- | D. | K+、Ca2+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
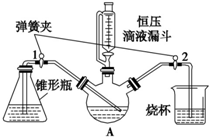 某化学兴趣小组用下图实验装置进行醋酸亚铬的制备研究.已知:醋酸亚铬(其中铬元素为二价)是红棕色晶体,不溶于水,在潮湿时,Cr2+极易被氧化成 Cr3+.(备注:Cr2+在溶液中为蓝色).
某化学兴趣小组用下图实验装置进行醋酸亚铬的制备研究.已知:醋酸亚铬(其中铬元素为二价)是红棕色晶体,不溶于水,在潮湿时,Cr2+极易被氧化成 Cr3+.(备注:Cr2+在溶液中为蓝色).
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| CO2(g) | H2(g) | CO(g) | H2O(g) | |
| 甲 | a mol | a mol | 0 | 0 |
| 乙 | a mol | 2a mol | 0 | 0 |
| 丙 | a mol | a mol | 0 | a mol |
| 丁 | amol | amol | amol | amol |
| A. | n(丁)>n(甲)>n(乙)>n(丙) | B. | n(丁)>n(甲)>n(丙)>n(乙) | C. | n(丁)>n(乙)>n(丙)>n(甲) | D. | n(丁)>n(乙)>n(甲)>n(丙) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去混在NO2中的NO:将气体与足量O2混合 | |
| B. | 除去混在CO2中的SO2:将气体依次通过足量酸性KMnO4溶液和浓硫酸 | |
| C. | 除去KCl溶液中的K2CO3:加入过量BaCl2溶液后过滤 | |
| D. | 除去乙酸中混有的乙醇:加入金属钠后蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应(2NO+O2=2NO2).(不考虑NO2与N2O4的转化)
如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应(2NO+O2=2NO2).(不考虑NO2与N2O4的转化)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g.cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com