
分析 若0.1mol•L-1NaHB溶液的pH=2,说明溶液中C(H+)=0.01mol/L,则HB-的电离度是10%,H2B第一步完全电离,第二步部分电离,且含有相同的离子能抑制弱根离子的电离;根据电离平衡常数的概念解答.
解答 解:若0.1mol•L-1NaHB溶液的pH=2,说明溶液中C(H+)=0.01mol/L,则HB-的电离度是10%,H2B第一步完全电离,第二步部分电离,由于H2B第一步电离产生的H+抑制了HB-的电离,故H2B(0.1 mol/L)的c(H+)小于0.11 mol/L;
HB-?H++B2-的电离平衡常数为:K=$\frac{c({H}^{+})•c({B}^{2-})}{c(H{B}^{-})}$,
故答案为:<;H2B第一步电离产生的H+对HB-的电离起了抑制作用;K=$\frac{c({H}^{+})•c({B}^{2-})}{c(H{B}^{-})}$.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度中等,明确电离平衡及其影响因素为解答关键,注意掌握电离平衡常数的概念及表达式.


科目:高中化学 来源: 题型:选择题
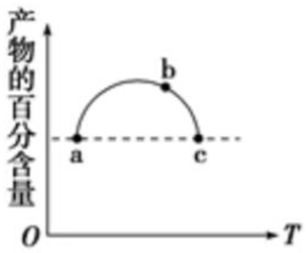 在恒容容器中充入一定量的SO2和Cl2,发生反应SO2(g)+Cl2(g)?SO2Cl2(g),测得体系中产物的百分含量与反应温度的变化如图所示,下列说法正确的是( )
在恒容容器中充入一定量的SO2和Cl2,发生反应SO2(g)+Cl2(g)?SO2Cl2(g),测得体系中产物的百分含量与反应温度的变化如图所示,下列说法正确的是( )| A. | a、b、c三点均为平衡点 | |
| B. | a、c两点的反应速率相同 | |
| C. | b点对应温度的平衡常数大于c点对应温度的平衡常数 | |
| D. | a、c两点体系的压强相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无法确定 | B. | NaOH | C. | BaCl2 | D. | FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各物质的浓度之比c(X):c(Y):c(Z)=2:3:4 | B. | 消耗2molX,同时消耗4molZ | ||
| C. | 混合气体的密度保持不变 | D. | 反应放出akJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化钠溶液显碱性:S2-+H2O═HS-+OH- | |
| B. | 硫酸铜溶液呈酸性:Cu2++2H2O?Cu(OH)2↓+2H+ | |
| C. | 氯化铝溶液与碳酸钠溶液混合:Al3++CO32-═Al(OH)3↓+H2↑ | |
| D. | 在饱和氯化铵溶液中撒入镁粉后微热:2NH4++Mg═Mg2++2NH3↑+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com