
”¾ĢāÄæ”æŅŌ»ĘĶæó£ØÖ÷ŅŖ³É·Ö¶žĮņ»ÆŃĒĢśĶCuFeS2£©ĪŖŌĮĻ£¬ÓĆFe2£ØSO4£©3ČÜŅŗ×÷½žČ”¼ĮĢįČ”Ķ£¬×Ü·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒCuFeS2+4Fe3+Cu2++5Fe2++2S£®
£Ø1£©øĆ·“Ó¦ÖŠ£¬Fe3+ĢåĻÖŠŌ£®
£Ø2£©ÉĻŹö×Ü·“Ó¦µÄŌĄķČēĶ¼1ĖłŹ¾£®øŗ¼«µÄµē¼«·“Ó¦Ź½ŹĒ £®
£Ø3£©Ņ»¶ØĪĀ¶ČĻĀ£¬æŲÖĘ½žČ”¼ĮpH=1£¬Č”Čż·ŻĻąĶ¬ÖŹĮæ»ĘĶæó·ŪÄ©·Ö±š½ųŠŠČēĻĀŹµŃé£ŗ
ŹµŃé | ²Ł×÷ | 2Š”Ź±ŗóCu2+½ž³öĀŹ/% |
I | ¼ÓČė×ćĮæ0.10molL©1 Fe2£ØSO4£©3ČÜŅŗ | 78.2 |
II | ¼ÓČė×ćĮæ0.10molL©1 Fe2£ØSO4£©3ČÜŅŗ£¬ĶØČėæÕĘų | 90.8 |
III | ¼ÓČė×ćĮæ0.10molL©1 Fe2£ØSO4£©3ČÜŅŗ£¬ŌŁ¼ÓČėÉŁĮæ0.0005molL©1 Ag2SO4ČÜŅŗ | 98.0 |
¢Ł¶Ō±ČŹµŃé I”¢II£¬ĶØČėæÕĘų£¬Cu2+½ž³öĀŹĢįøßµÄŌŅņŹĒ £®
¢ŚÓÉŹµŃé IIIĶĘ²ā£¬ŌŚ½žČ”Cu2+¹ż³ĢÖŠAg+×÷“߻ƼĮ£¬“ß»ÆŌĄķŹĒ£ŗ
¢”£®CuFeS2+4Ag+ØTFe2++Cu2++2Ag2S
¢¢£®Ag2S+2Fe3+ØT2Ag++2Fe2++S
ĪŖÖ¤Ć÷øĆ“ß»ÆŌĄķ£¬½ųŠŠČēĻĀŹµŃé£ŗ
a£®Č”ÉŁĮæ»ĘĶæó·ŪÄ©£¬¼ÓČėÉŁĮæ0.0005molL©1 Ag2SO4ČÜŅŗ£¬³ä·Ö»ģŗĻŗó¾²ÖĆ£®Č”ÉĻ²ćĒåŅŗ£¬¼ÓČėĻ”ŃĪĖį£¬¹Ū²ģµ½ČÜŅŗÖŠ £¬ Ö¤Ć÷·¢Éś·“Ó¦ i£®
b£®Č”ÉŁĮæAg2S·ŪÄ©£¬¼ÓČėČÜŅŗ£¬³ä·Ö»ģŗĻŗó¾²ÖĆ£®Č”ÉĻ²ćĒåŅŗ£¬¼ÓČėĻ”ŃĪĖį£¬ÓŠ°×É«³Įµķ£¬Ö¤Ć÷·¢Éś·“Ó¦ ii£®
£Ø4£©ÓĆŹµŃé IIµÄ½žČ”Ņŗµē½āĢįČ”ĶµÄŌĄķČēĶ¼2ĖłŹ¾£ŗ 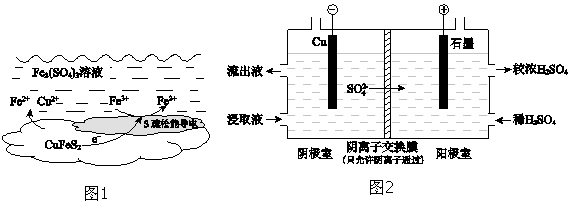
¢Łµē½ā³õĘŚ£¬Ņõ¼«Ć»ÓŠĶĪö³ö£®ÓƵē¼«·“Ó¦Ź½½āŹĶŌŅņŹĒ £®
¢Ś½«Ņõ¼«ŹŅµÄĮ÷³öŅŗĖĶČėŃō¼«ŹŅ£¬æÉŹ¹½žČ”¼ĮŌŁÉś£¬ŌŁÉśµÄŌĄķŹĒ £®
”¾“š°ø”æ
£Ø1£©Ńõ»Æ
£Ø2£©CuFeS2©4e©ØTFe2++2S+Cu2+
£Ø3£©ĶØČėO2ŗó,·¢Éś·“Ó¦4Fe2++O2+4H+ØT4Fe3++2H2O,c£ØFe2+£©½µµĶ,c£ØFe3+£©Éżøß,×Ü·“Ó¦µÄĘ½ŗāÕżĻņŅĘ¶Æ£»ĪŽĆ÷ĻŌĻÖĻó£» pH=1µÄ0.10mol?L©1Fe2£ØSO4£©3ČÜŅŗ
£Ø4£©Fe3++e©ØTFe2+£» Fe2+ŌŚŃō¼«Ź§µē×ÓÉś³ÉFe3+£ŗFe2+©e©ØTFe3+,SO42©ĶعżŅõĄė×Ó½»»»Ä¤½ųČėŃō¼«ŹŅ,Fe2£ØSO4£©3ČÜŅŗŌŁÉś
”¾½āĪö”æ½ā£ŗ£Ø1£©CuFeS2+4Fe3+Cu2++5Fe2++2S£¬·“Ó¦ÖŠĢśŌŖĖŲ»ÆŗĻ¼Ū+3¼Ū±ä»ÆĪŖ+2¼Ū£¬×öŃõ»Æ¼Į±»»¹Ō·¢Éś»¹Ō·“Ó¦£¬
ĖłŅŌ“š°øŹĒ£ŗŃõ»Æ£»£Ø2£©CuFeS2+4Fe3+Cu2++5Fe2++2S£¬øŗ¼«ŹĒCuFeS2Ź§µē×Ó·¢ÉśŃõ»Æ·“Ó¦£¬µē¼«·“Ó¦ĪŖ£ŗCuFeS2©4e©ØTFe2++2S+Cu2+£¬
ĖłŅŌ“š°øŹĒ£ŗCuFeS2©4e©ØTFe2++2S+Cu2+£»£Ø3£©¢ŁŅ»¶ØĪĀ¶ČĻĀ£¬æŲÖĘ½žČ”¼ĮpH=1£¬Č”Čż·ŻĻąĶ¬ÖŹĮæ»ĘĶæó·ŪÄ©£¬¼ÓČė×ćĮæ0.10molL©1 Fe2£ØSO4£©3ČÜŅŗ£¬·¢Éś·“Ӧɜ³ÉŃĒĢśĄė×Ó”¢ĶĄė×ÓŗĶµ„ÖŹĮņ£¬ĘäÖŠŃĒĢśĄė×Ó±»ŃõĘųŃõ»ÆĪŖĢśĄė×Ó£¬ĶØČėO2ŗ󣬷¢Éś·“Ó¦4Fe2++O2+4H+ØT4Fe3++2H2O£¬c£ØFe2+£©½µµĶ£¬c£ØFe3+£©Éżøߣ¬×Ü·“Ó¦µÄĘ½ŗāÕżĻņŅĘ¶Æ£¬
ĖłŅŌ“š°øŹĒ£ŗĶØČėO2ŗ󣬷¢Éś·“Ó¦4Fe2++O2+4H+ØT4Fe3++2H2O£¬c£ØFe2+£©½µµĶ£¬c£ØFe3+£©Éżøߣ¬×Ü·“Ó¦µÄĘ½ŗāÕżĻņŅĘ¶Æ£»
¢Śa£®ĪŽĆ÷ĻŌĻÖĻó£»
b£®pH=1µÄ0.10 molL©1Fe2£ØSO4£©3ČÜŅŗ£»£Ø4£©¢Łµē½ā³õĘŚ£¬Ņõ¼«Ć»ÓŠĶĪö³ö£®½žČ”ŅŗÖŠŗ¬¹żĮæµÄĢśĄė×Ó£¬ĢśĄė×ÓŃõ»ÆŠŌ“óÓŚĶÓÅĻČ·Åµē£¬µē¼«·“Ó¦Fe3++e©ØTFe2+£¬
ĖłŅŌ“š°øŹĒ£ŗFe3++e©ØTFe2+£»
¢Ś½«Ņõ¼«ŹŅµÄĮ÷³öŅŗĖĶČėŃō¼«ŹŅ£¬æÉŹ¹½žČ”¼ĮŌŁÉś£¬ŌŁÉśµÄŌĄķŹĒFe2+ŌŚŃō¼«Ź§µē×ÓÉś³ÉFe3+£ŗFe2+©e©ØTFe3+£¬SO42©ĶعżŅõĄė×Ó½»»»Ä¤½ųČėŃō¼«ŹŅ£¬Fe2£ØSO4£©3ČÜŅŗŌŁÉś£¬
ĖłŅŌ“š°øŹĒ£ŗFe2+ŌŚŃō¼«Ź§µē×ÓÉś³ÉFe3+£ŗFe2+©e©ØTFe3+£¬SO42©ĶعżŅõĄė×Ó½»»»Ä¤½ųČėŃō¼«ŹŅ£¬Fe2£ØSO4£©3ČÜŅŗŌŁÉś£»


 æŚĖćÄÜŹÖĻµĮŠ“š°ø
æŚĖćÄÜŹÖĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æøł¾ŻŅŃѧĪļÖŹ½į¹¹ÓėŠŌÖŹµÄÓŠ¹ŲÖŖŹ¶£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ĒėŠ“³öµŚČżÖÜĘŚŌŖĖŲÖŠp¹ģµĄÉĻÓŠ3øöĪ“³É¶Ōµē×ÓµÄŌŖĖŲ·ūŗÅ£ŗ £¬ ijŌŖĖŲ±»æĘѧ¼Ņ³ĘÖ®ĪŖČĖĢåĪ¢ĮæŌŖĖŲÖŠµÄ”°·Ą°©Ö®Ķõ”±£¬ĘäŌ×ÓµÄĶāĪ§µē×ÓÅŲ¼ŹĒ4s24p4 £¬ øĆŌŖĖŲµÄĆū³ĘŹĒ £®
£Ø2£©øł¾Ż¼Ū²ćµē×Ó¶Ō»„³āĄķĀŪĶĘ²āĻĀĮŠĄė×Ó»ņ·Ö×ÓµÄæÕ¼äĮ¢Ģå¹¹ŠĶ£ŗH3O+ £¬ BF3 £®
£Ø3£©ĻņŹ¢ÓŠĮņĖįĶĖ®ČÜŅŗµÄŹŌ¹ÜĄļ¼ÓČė°±Ė®£¬Ź×ĻČŠĪ³ÉÄŃČÜĪļ£¬¼ĢŠųĢķ¼Ó°±Ė®£¬ÄŃČÜĪļČܽā£¬µĆµ½ÉīĄ¶É«µÄĶøĆ÷ČÜŅŗ£¬Š“³öÓŠ¹Ų·“Ó¦µÄĄė×Ó·½³ĢŹ½”¢ £®
£Ø4£©½šŹōĢśµÄ¾§ĢåŌŚ²»Ķ¬ĪĀ¶ČĻĀÓŠĮ½Öֶѻż·½Ź½£¬¾§°ū·Ö±šČēĶ¼ĖłŹ¾£®ŌņĢåŠÄĮ¢·½¾§°ūŗĶĆęŠÄĮ¢·½¾§°ūÖŠŹµ¼Źŗ¬ÓŠµÄFeŌ×ÓøöŹżÖ®±ČĪŖ£»ČōĮ½ÖÖ¾§ĢåÖŠ×īĮŚ½üµÄĢśŌ×Ó¼ä¾ąĄėĻąĶ¬£¬ŌņĢåŠÄĮ¢·½¾§°ūŗĶĆęŠÄĮ¢·½¾§°ūµÄĆܶČÖ®±ČĪŖ £® 
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÅš£ØB£©”¢ĀĮ£ØAl£©”¢ļŲ£ØGa£©¾łŹōÓŚÅš×åŌŖĖŲ£ØµŚ¢óA×壩£¬ĖüĆĒµÄ»ÆŗĻĪļ»ņµ„ÖŹ¶¼ÓŠÖŲŅŖÓĆĶ¾£®»Ų“šĻĀĮŠĪŹĢā£ŗ 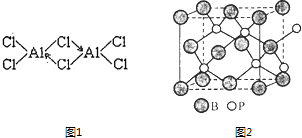
£Ø1£©Š“³ö»łĢ¬ļŲŌ×ӵĵē×ÓÅŲ¼Ź½ £®
£Ø2£©ŅŃÖŖ£ŗĪŽĖ®ĀČ»ÆĀĮŌŚ178”ęÉż»Ŗ£¬ĖüµÄÕōĘųŹĒµŽŗĻµÄĖ«·ÖÓŚ£ØAl2Cl6£©£¬½į¹¹ČēĶ¼1µŽŗĻĖ«·Ö×ÓAl2Cl6ÖŠAlŌ×ӵĹģµĄŌÓ»ÆĄąŠĶŹĒ £®
£Ø3£©BŌ×ӵĵē×ÓÓŠøö²»Ķ¬µÄÄܼ¶£»¾§ĢåÅšČŪµćĪŖ2300”ę£¬ŌņĘäĪŖ¾§Ģ壮
£Ø4£©Į×»ÆÅš£ØBP£©ŹĒŅ»ÖÖÓŠ¼ŪÖµµÄÄĶÄ„Ó²Ķæ²ć²ÄĮĻ£¬ĖüŹĒĶعżŌŚøßĪĀĒāĘų·ÕĪ§ĻĀ£Ø£¾750”ę£©Čżäå»ÆÅšŗĶČżäå»ÆĮ×·“Ó¦ÖĘµĆ£®BP¾§°ūČēĶ¼2ĖłŹ¾£® ¢Ł»³öČżäå»ÆÅšŗĶČżäå»ÆĮ×µÄæÕ¼ä½į¹¹Ź½£®
Čżäå»ÆÅšČżäå»ÆĮ×
¢ŚŌŚBP¾§°ūÖŠBµÄ¶Ń»ż·½Ź½ĪŖ £®
¢Ū¼ĘĖćµ±¾§°ū¾§øń²ĪŹżĪŖapm£Ø¼“Ķ¼ÖŠĮ¢·½ĢåµÄĆæĢõ±ß³¤ĪŖapm£©Ź±£¬Į×»ÆÅšÖŠÅšŌ×ÓŗĶĮ×Ō×ÓÖ®¼äµÄ×ī½ü¾ąĄė £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŃŠ¾æ±ķĆ÷£ŗ¶ąÖÖŗ£²śĘ·ČēĻŗ”¢Š·”¢ÄµņĆµČ£¬ĢåÄŚŗ¬ÓŠ+5¼ŪµÄÉé£ØAs£©ŌŖĖŲ£¬µ«Ėü¶ŌČĖĢåŹĒĪŽ¶¾µÄ£¬ÅųĖŖµÄ³É·ÖŹĒAs2O3£¬Źō¾ē¶¾ĪļÖŹ£¬×ؼŅÖŅøę£ŗ³Ō·¹Ź±²»ŅŖĶ¬Ź±“óĮæŹ³ÓĆŗ£ĻŹŗĶĒą²Ė£¬·ńŌņČŻŅ×ÖŠ¶¾£¬²¢øų³öĮĖŅ»øö¹«Ź½£ŗ“óĮæŗ£ĻŹ+“óĮæĪ¬ÉśĖŲC=ÅųĖŖ£®ĻĀĆęÓŠ¹Ų½āŹĶ²»ÕżČ·µÄÓ¦øĆŹĒ
A£®Ēą²ĖÖŠŗ¬ÓŠĪ¬ÉśĖŲC
B£®Ī¬ÉśĖŲC¾ßÓŠ»¹ŌŠŌ
C£®ÖĀČĖÖŠ¶¾¹ż³ĢÖŠÉé·¢Éś»¹Ō·“Ó¦
D£®ÅųĖŖŹĒŃõ»Æ²śĪļ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČ”100 mL 0.3 mol/LŗĶ300 mL 0.25 mol/LµÄĮņĖį×¢Čė500 mLČŻĮæĘæÖŠ£¬¼ÓĖ®Ļ”ŹĶÖĮæĢ¶ČĻߣ¬øĆ»ģŗĻČÜŅŗÖŠH£«µÄĪļÖŹµÄĮæÅØ¶ČŹĒ (”” ””)
A. 0.21 mol/L B. 0.42 mol/L C. 0.56 mol/L D. 0.26 mol/L
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĮ½ÖÖŌŖĖŲµÄŗĖĶāµē×Ó²ćŹżÖ®±ČÓė×īĶā²ćµē×ÓŹżÖ®±ČĻąµČ£¬ŌņŌŚŗĖµēŗÉŹż1~10µÄŌŖĖŲÖŠ£¬Āś×ćÉĻŹö¹ŲĻµµÄŌŖĖŲ¹²ÓŠ£Ø £©
A.1¶ŌB.2¶ŌC.3¶ŌD.4¶Ō
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚÄ³ĪļÖŹÖŠ¼ÓČėĒāŃõ»ÆÄĘČÜŅŗŗó¼ÓČČ²śÉśÄÜŹ¹ŹŖČóŗģÉ«ŹÆČļŹŌÖ½±äĄ¶µÄĘųĢ壬Čō¼ÓČėŃĪĖįČÜŅŗ£¬²śÉśÄÜŹ¹³ĪĒåŹÆ»ŅĖ®±ä»ė×ĒµÄĘųĢ壬ŌņøĆĪļÖŹ²»æÉÄÜŹĒ
A.NH4HCO3B.(NH4)2CO3C.(NH4)2SO4D.(NH4)2SO3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ»ÆѧŅ©Ę·Óė¾ÆŹ¾Óļ¶ŌÓ¦ÕżČ·µÄŹĒ£Ø””””£©
¢Ł¾Ę¾«”Ŗ”Ŗ¾ē¶¾Ę·””¢ŚÅØĮņĖį”Ŗ”ŖøÆŹ“Ę·””¢ŪĘūÓĶ”Ŗ”ŖŅ×Č¼Ę·””¢ÜÉÕ¼ī”Ŗ”Ŗ¾ē¶¾Ę·””¢ŻĀČĖį¼Ų”Ŗ”ŖŃõ»Æ¼Į ¢ŽĻõĖįļ§”Ŗ”Ŗ±¬ÕØĘ·
A. ¢Ł¢Ś¢Ū¢Ž B. ¢Ł¢Ś¢Ż C. ¢Ł¢Ü¢Ż D. ¢Ś¢Ū¢Ż¢Ž
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ·“Ó¦ŹōÓŚµŖµÄ¹Ģ¶ØµÄŹĒ
¢ŁN2ŗĶH2ŌŚŅ»¶ØĢõ¼žĻĀ·“Ӧɜ³ÉNH3
¢ŚĄ×ÓźÉĮµēŹ±æÕĘųÖŠµÄN2ŗĶO2»ÆŗĻÉś³ÉNO
¢ŪNH3¾¹ż“ß»ÆŃõ»ÆÉś³ÉNO
¢ÜNH3ŗĶHNO3·“Ӧɜ³ÉNH4NO3
A.¢Ł¢ŪB.¢Ś¢ÜC.¢Ū¢ÜD.¢Ł¢Ś
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com