
【题目】短周期元素A、B、C、D、E、F六种元素,它们的原子序数由A到F依次增大。在周期表中,A的原子半径最小。B元素的原子最外层电子数是内层电子数的两倍,C为地壳中含量最多的元素,D是原子半径最大的短周期主族元素,D单质燃烧时呈现黄色火焰,D的单质在高温下与C的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物。D与F形成的离子化合物DF是常用的调味品。试根据以上叙述回答:
(1)元素名称:
A________、B________、C________、D________。
(2)E在元素周期表中的位置:_________________________________________________。
(3)F离子结构示意图:_____________________________________________________。
(4)A、B组成的最简单化合物的名称是____________________________________________。
(5)C、D按原子个数比1∶1组成的一种化合物与水发生反应的化学方程式为___________________________________________________________。
(6)能说明E的非金属性比F的非金属性____(填“强”或“弱”)的事实是________(举一例)。
【答案】氢 碳 氧 钠 第三周期第Ⅵ A族  甲烷 2Na2O2+2H2O=4NaOH+O2↑ 弱 氯气能从硫化钠溶液中置换出硫等(合理答案均可)
甲烷 2Na2O2+2H2O=4NaOH+O2↑ 弱 氯气能从硫化钠溶液中置换出硫等(合理答案均可)
【解析】
根据“A的原子半径最小”知A为H;根据“C为地壳中含量最多的元素”可知C为O;B为第二周期元素,原子结构为![]() ,则B为C;根据“D是原子半径最大的短周期主族元素”可知D为Na,Na在O2中燃烧生成Na2O2为淡黄色,则E为硫;根据“D与F形成的离子化合物DF是常用的调味品”可知DF为NaCl,则F为Cl;综上所述,A为H,B为C,C为O,D为Na,E为S,F为Cl,依此作答。
,则B为C;根据“D是原子半径最大的短周期主族元素”可知D为Na,Na在O2中燃烧生成Na2O2为淡黄色,则E为硫;根据“D与F形成的离子化合物DF是常用的调味品”可知DF为NaCl,则F为Cl;综上所述,A为H,B为C,C为O,D为Na,E为S,F为Cl,依此作答。
经分析,A为H,B为C,C为O,D为Na,E为S,F为Cl;
(1)A为氢,B为碳,C为氧,D为钠;
(2)E为S,其在周期表中的位置为第三周期,VI A族;
(3)F离子为Cl-,其离子结构示意图为 ;
;
(4)A、B组成的最简单的化合物为CH4;
(5)该化合物为Na2O2,其和水反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑;
(6)E为S,F为Cl,则S的非金属性比Cl弱,对应的事实是氯气能从硫化钠溶液中置换出硫(非金属性越强的元素,其单质的氧化性越强)。


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
【题目】高纯氧化铁可作现代电子工业材料。以下是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)的生产流程示意图。已知当溶液的pH大于6.5,Fe2+开始转化成Fe(OH)2。

(1)步骤Ⅰ中过滤所得滤渣的主要成分是____,工业上可以利用一种弱酸溶解该物质,该弱酸为____。
(2)步骤Ⅱ中加入铁粉的目的是____。
(3)写出步骤Ⅳ中反应的离子方程式____。
(4)在空气中煅烧FeCO3可制备高纯氧化铁,煅烧所需的主要仪器为____(写一种仪器名称),FeCO3在煅烧前应充分洗涤干净,写出实验室洗涤沉淀的方法____。
(5)写出煅烧FeCO3可制备高纯氧化铁反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Calanolide A是一种抗HIV药物,其结构简式如图所示。下列关于Calanolide A的说法错误的是( )

A. 分子中有3个手性碳原子
B. 分子中有3种含氧官能团
C. 该物质既可发生消去反应又可发生加成反应
D. 1mol该物质与足量NaOH溶液反应时消耗1molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X位于第4周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2;元素Y基态原子的3p轨道上有1对成对电子。X与Y形成的化合物的晶胞结构如图所示,下列关于该晶体的说法正确的是( )
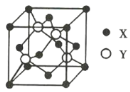
A.该晶体属于原子晶体
B.X2+的配位数为8,Y2-的配位数为4
C.与每个Y2-距离最近且相等的Y2-共有12个
D.该晶体的熔点比氧化锌高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁[Fe(C5H5)2]可用作火箭燃料添加剂、汽油的抗爆剂和橡胶的熟化剂,也可作紫外线吸收剂。可由环戊二烯(![]() )和FeCl2在三乙胺[(C2H5)3N]存在下反应制得。
)和FeCl2在三乙胺[(C2H5)3N]存在下反应制得。
(1)在元素周期表中,与Fe既同周期又同族且价层电子总数为10的元素是_____(填元素符号),该元索基态原子核外N层电子的自旋状态_______(填“相同”或“相反”)。
(2)三乙胺中电负性最小的元素是________(填元素符号);C元素的_______杂化轨道与H元素的________轨道形成_______键。
(3)下列状态的Cl中,电离最外层一个电子所需能量最大的是______(填序号)。
A. [Ne]![]() B. [Ne]
B. [Ne] ![]()
C. [Ne] ![]() D. [Ne]
D. [Ne] ![]()
(4)已知:分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成的大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成的大π键的电子数(如苯分子中的大π键可表示为![]() ),则环戊二烯负离子(
),则环戊二烯负离子(![]() )中的大π键应表示为________。
)中的大π键应表示为________。
(5)二茂铁易升华且可溶于有机溶剂中,其晶体类型为________,二茂铁的晶胞结构如图所示(未画出微粒),密度为pg·cm-3,则一个晶胞中Fe(C5H5)2。数目的计算表达式为______(设阿伏加德罗常数的值为NA)。
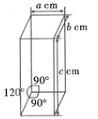
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,一定能大量共存的是
A. NH![]() 、SO
、SO![]() 、CO
、CO![]() 、K+ B. Na+、Ba2+、Ca2+、HCO
、K+ B. Na+、Ba2+、Ca2+、HCO![]()
C. Mg2+、SO![]() 、K+、Cl- D. K+、Cl-、Na+、SO
、K+、Cl- D. K+、Cl-、Na+、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯类化合物与格氏试剂(RMgX,X=Cl、Br、I)的反应是合成叔醇类化合物的重要方法,可用于制备含氧多官能团化合物。化合物F合成路线如下,回答下列问题:

已知信息如下:
①RCH=CH2![]() RCH2CH2OH
RCH2CH2OH
②![]()
③RCOOCH3![]()
(1)A的结构简式为___,B→C的反应类型为__,C中官能团的名称为__,C→D的反应方程式为___。
(2)写出符合下列条件的D的同分异构体__(填结构简式,不考虑立体异构)。
①含有五元碳环结构;②能与NaHCO3溶液反应放出CO2;③能发生银镜反应。
(3)判断化合物F中有无手性碳原子,若有用“*”标出。__
(4)已知羟基能与格氏试剂发生反应。写出以![]() 、CH3OH和格氏试剂为原料制备
、CH3OH和格氏试剂为原料制备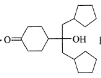 的合成路线(其它试剂任选)。__
的合成路线(其它试剂任选)。__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性无色溶液中可能含下表离子中的若干种离子。
阳离子 | Mg2+、NH4+、Ba2+、Al3+、Fe2+ |
阴离子 | SiO32-、MnO4-、Cl-、NO3-、SO42- |
实验Ⅰ:取少量该强酸性溶液A进行如下实验。

实验Ⅱ:为了进一步确定该溶液的组成,取100 mL原溶液A,向该溶液中滴加1 mol·L-1的NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。
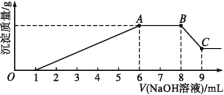
回答下列问题:
(1)不进行实验就可以推断出,上表中的离子一定不存在的有________种。
(2)通过实验Ⅰ可以确定该溶液中一定存在的阴离子是_________。检验气体X的方法是_______________;沉淀Z的化学式为_____________。
(3)写出实验Ⅱ的图示中BC段对应反应的离子方程式:________________。
(4)A点对应的固体质量为____ g。
(5)通过上述信息,推算该溶液中阴离子的浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)实验过程如图:

Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T形导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2 mL的溶液流入D试管中,检验其中的阳离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是________________________。
(2)棉花中浸润的溶液为__________________。作用是_______________________。
(3)A中发生反应的化学方程式:______________________________________。
(4)导致步骤Ⅲ中溶液变黄的离子反应是______________________________。用______________(写试剂化学式)检验氧化产物,现象是___________________________。
(5)能说明氧化性Fe3+>SO2的离子方程式是__________________________。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是________________(填“甲”“乙”或“丙”)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com