
 (1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.
(1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
| 化学键 | P-P | P-O | P=O | O-O | O=O |
| 键能(kJ/mol) | a | b | c | d | e |
分析 (1)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.
(2)根据反应热等于反应物的总键能与生成物的总键能之差计算.
(3)依据盖斯定律,结合题干热化学方程式计算写出.
解答 解:(1)在反应CH3-CH3→CH2=CH2+H2中,断裂6mol C-H键,1mol C-C键共吸收的能量为:6×414kJ+347kJ=2831kJ,生成1molCH2=CH2和1molH2,共形成4molC-H键,1molC=C、1molH-H,共放出的能量为:4×414kJ+615kJ+435kJ=2706kJ,吸收的能量多,放出的能量少,该反应为吸热反应,吸收的热量为:2831kJ-2706kJ=125,所以反应热为+125kJ/mol,故答案为:+125 kJ/mol.
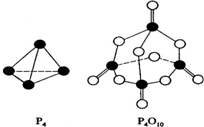
(2)白磷燃烧生成P4O6的热化学方程式为P4(s)+3O2(g)=P4O6(s);△H=6×198kkJ/mol+3×498kJ/mol-12×360kJ/mol=-1638kJ/mol,则0.5mol白磷(P4)与O2完全反应生成固态P4O6放出的热量为0.5mol×1638kJ/mol=819kJ,故答案为:819kJ•mol-1.
(3)①N2(g)+2O2(g)=N2O4(l)△H1=-195kJ?mol-1
②N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
根据盖斯定律写出肼和N2O4反应的热化学方程:②×2-①得到:2N2H4(l)++N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol;
故答案为:2N2H4(l)++N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol.
点评 本题主要考查了利用键能计算反应热、盖斯定律的应用,灵活处理已知的热化学方程式是解题的关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
| 化学键 | N-H | N-N | N≡N | O-H |
| 键能(kJ.mol-1) | 390 | 190 | 946 | 460 |

| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/(mol/L) | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/(mol/L) | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ①④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 加热前的质量 | 加热后的质量 | ||
| W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) | |
| 第一次 | 15.688g | 17.668g | 16.962g |
| 第二次 | 15.688g | 17.744g | 17.033g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10s内,NH3的平均反应速率为0.008mol•L-1•s-1 | |
| B. | 该反应达到平衡时6v(O2)正=5v(H2O)逆 | |
| C. | 10s内,反应放出的热量为0.1akJ | |
| D. | 10s时,H2O的反应速率为0.012mol•L-1•s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com