
分析 氯气溶于水发生反应Cl2+H2O?HCl+HClO,新制氯水含有Cl2、H2O、HClO、H+、Cl-等粒子,其中H+可与碳酸钙等物质反应,而Cl2、HClO具有强氧化性,HClO具有漂白性,溶液中含有Cl-可与硝酸银反应生成白色AgCl沉淀,以此解答该题.
解答 解:(1)氯气的颜色是黄绿色,故答案为:Cl2;
(2)溶液中含有Cl-,Cl-可与硝酸银反应生成白色AgCl沉淀,故答案为:Cl-;
(3)另取少量氯水于表面皿中,将一块蓝色石蕊试纸置于其中,发现试纸先变红说明存在氢离子,然后褪色,说明氯水中含有的粒子是HClO,故答案为:H+,HClO;(4)以上实验不能说明溶液中是否有氯气存在,故答案为:Cl2;
(5)通过以上分析知,溶液中中有HCl、HClO和Cl2,所以溶液中存在一个反应平衡,故答案为:Cl2+H2O?HCl+HClO;
点评 本题考查了氯气的化学性质及氯水的成分,侧重考查学生对氯水成分的分析能力.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Mg2+、OH-、Br- | B. | H+、Ag+、Cl-、ClO- | ||
| C. | Na+、K+、SO42-、Cl- | D. | Ba2+、H+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第3列元素种类最多,第14列元素形成的化合物种类最多 | |
| B. | 每一列都有非金属元素 | |
| C. | 从上到下第1列元素的单质熔点逐渐升高,而第17列元素的单质熔点逐渐降低 | |
| D. | 只有第2列元素的原子最外层有2个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Cl-、K+、NO3- | B. | CO32-、Na+、Cl-、K+ | ||
| C. | Fe3+、Mg2+、NO3-、Cl- | D. | Na+、Ag+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

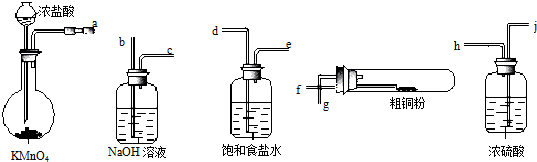
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
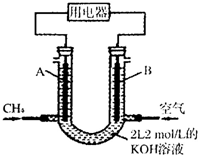 合理利用碳氢化合物以及二氧化碳捕集、存储和转化是当今化学研究的热点问题之一.
合理利用碳氢化合物以及二氧化碳捕集、存储和转化是当今化学研究的热点问题之一.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
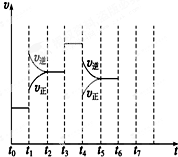 在一密闭容器中发生反应N2+3H22NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
在一密闭容器中发生反应N2+3H22NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
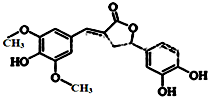
| A. | 分子中含有三种官能团 | |
| B. | 1 mol 该化合物最多能与6 mol NaOH 反应 | |
| C. | 1 mol 该化合物最多能与含4 molBr2的浓溴水反应 | |
| D. | 既能与FeCl3发生显色反应,也能和NaHCO3反应放出CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 五价砷在维生素C作用下发生了还原反应 | |
| B. | “两者同食”发生的反应中维生素C作还原剂 | |
| C. | 河虾中含有的五价砷,没有毒性 | |
| D. | 毒药砒霜是含砷的氧化物,可以推测砒霜中所含的砷元素化合价为+5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com