
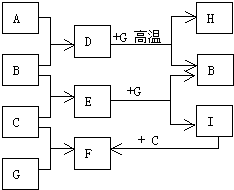
 单质A、B、C在常温下均为气态,分别由甲、乙、丙三种短周期元素组成;丙元素的原子结构中次外层电子数比最外层电子数多1;G是常见的金属单质,D在常温下为液态,H是一种黑色晶体.各物质间的转化关系如图所示(反应条件多数已略去).
单质A、B、C在常温下均为气态,分别由甲、乙、丙三种短周期元素组成;丙元素的原子结构中次外层电子数比最外层电子数多1;G是常见的金属单质,D在常温下为液态,H是一种黑色晶体.各物质间的转化关系如图所示(反应条件多数已略去).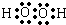 ;
;分析 单质A、B、C在常温下均为气态,分别由甲、乙、丙三种短周期元素组成,丙元素的原子结构中次外层电子数比最外层电子数多1,则丙为氯元素,则C为氯气,甲、乙两种元素还可形成一种有4个原子核和18个电子的化合物,该化合物应为双氧水,则甲乙为氧元素和氢元素,D在常温下为液态,则D为水,B与C反应生成E,则B为氢气,E为氯化氢,G是常见的金属单质,H是一种黑色晶体,G能与水在高温下反应生成H和氢气,则G为铁,H为四氧化三铁,铁与盐酸反应生成I为氯化亚铁,氯化亚铁与氯气反应生成F为氯化铁,铁与氯气反应也生成氯化铁,符合转化关系,据此答题.
解答 解:单质A、B、C在常温下均为气态,分别由甲、乙、丙三种短周期元素组成,丙元素的原子结构中次外层电子数比最外层电子数多1,则丙为氯元素,则C为氯气,甲、乙两种元素还可形成一种有4个原子核和18个电子的化合物,该化合物应为双氧水,则甲乙为氧元素和氢元素,D在常温下为液态,则D为水,B与C反应生成E,则B为氢气,E为氯化氢,G是常见的金属单质,H是一种黑色晶体,G能与水在高温下反应生成H和氢气,则G为铁,H为四氧化三铁,铁与盐酸反应生成I为氯化亚铁,氯化亚铁与氯气反应生成F为氯化铁,铁与氯气反应也生成氯化铁,符合转化关系,
(1)甲、乙两种元素形成的有4个原子核和18个电子的化合物为双氧水,其电子式为 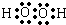 ,
,
故答案为: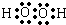 ;
;
(2)C为氯气,实验室制取C的离子方程式为 MnO2+4 H++2 Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2 H2O,铁与水在高温下反应的化学方程式为3 Fe+4 H2O(g) $\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4 H2,
故答案为:MnO2+4 H++2 Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2 H2O;3 Fe+4 H2O(g) $\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4 H2;
(3)B为氢气,C为氯气,B在C中燃烧的现象是氢气在氯气中安静燃烧,发出苍白色火焰,在通常状况下,1g 氢气的物质的量为0.5mol,所以1mol氢气在氧气中完全燃烧,生成液态水时,放出142.9×2kJ=285.8kJ的热量,则表示氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 kJ/mol,
故答案为:氢气在氯气中安静燃烧,发出苍白色火焰; H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 kJ/mol;
(4)E为氯化氢,以石墨为电极电解E的水溶液,阳极反应式为2 Cl--2 e-=Cl2↑,
故答案为:2 Cl--2 e-=Cl2↑;
(5)F为氯化铁,实验室检验铁离子的操作方法是取少量溶液置于一支试管中,滴入几滴KSCN溶液,观察溶液是否变红色,如果变红,则证明有Fe3+,
故答案为:取少量溶液置于一支试管中,滴入几滴KSCN溶液,观察溶液是否变红色,如果变红,则证明有Fe3+.
点评 题考查了无机物的推断,侧重考查学生分析推断能力,涉及物质推断、离子方程式的书写、气体制取等知识点,熟悉常见物质之间的转化及物质性质是解本题关键,注意根据原子核外电子排布特点进行元素的推断,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
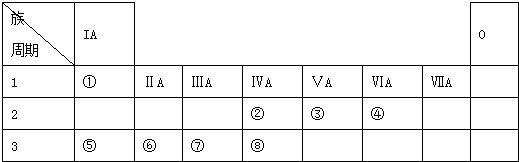
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
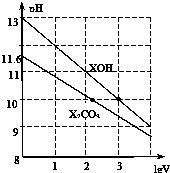 体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是( )
体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是( )| A. | XOH是强碱 | |
| B. | pH=10的两种溶液中的c(X+):XOH大于X2CO3 | |
| C. | 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1×10-10•2 | |
| D. | 当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
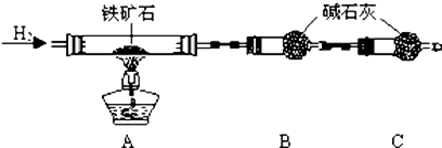
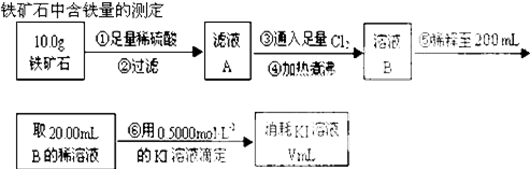
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
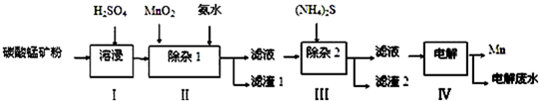
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Fe3+、SO42-、Cl- | B. | CO32-、PO43-、K+、Na+ | ||
| C. | Na+、SO42-、NO3-、Cl- | D. | HCO3-、Na+、HSO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该物质一定是钠的化合物 | B. | 该物质一定是金属钠 | ||
| C. | 该物质一定含钠元素 | D. | 可确定该物质中不含钾元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁跟稀硫酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| B. | 钠跟水反应 Na+H2O═Na++OH-+H2↑ | |
| C. | 大理石跟稀盐酸反应 CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 氯气通入水中 Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式是:CH2=CH2 | B. | 乙醇的分子式是:CH3CHO | ||
| C. | 甲烷的结构式是:CH4 | D. | 乙酸的官能团是:-OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com