
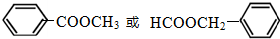 (任写一种).
(任写一种). 分析 (1)相同条件下,气体的密度之比等于其相对分子质量之比;
(2)计算A、二氧化碳、水的物质的量,根据原子守恒确定A分子中C、H原子数目,结合相对分子质量确定O原子数目,进而确定分子式;
(3)若A能与NaHCO3溶液反应放出CO2气体,说明A含有羧基,结合分子式确定可能的结构简式;
(4)若A与NaOH溶液在加热时才能反应,且1mol A消耗1mol NaOH,说明A含有酯基,结合分子式判断可能的结构简式.
解答 解:(1)有机化合物对空气的相对密度是4.69,可知有机物相对分子质量为4.69×29=136,
故答案为:136;
(2)A的物质的量为0.1mol,CO2的物质的量为$\frac{17.92L}{22.4L/mol}$=0.8mol,H2O的物质的量为$\frac{7.2g}{18g/mol}$=0.4mol,则分子中C原子数目为$\frac{0.8mol}{0.1mol}$=8,H原子数目为$\frac{0.4mol×2}{0.1mol}$=8,则分子中O原子数目为$\frac{136-12×8-8}{16}$=2,故A的分子式为:C8H8O2,
故答案为:C8H8O2;
(3)若A能与NaHCO3溶液反应放出CO2气体,说明A含有羧基,A的不饱和度为$\frac{2×8+2-8}{2}$=5,应含有苯环,可能为苯乙酸、对甲基苯甲酸、邻甲基苯甲酸、间甲基苯甲酸,
故答案为:4;
(4)若A与NaOH溶液在加热时才能反应,且1mol A消耗1mol NaOH,说明A含有酯基,且是羧酸与醇形成的酯基,可能的结构简式为: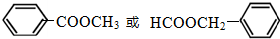 ,
,
故答案为: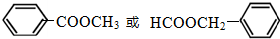 .
.
点评 本题考查有机物分子式与结构式的确定、同分异构体书写等,掌握燃烧法利用原子守恒确定有机物分子式,注意根据不饱和度判断含有苯环.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:解答题
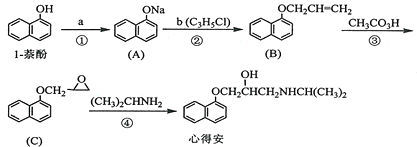
 .
. ;由F生成一硝化产物的化学方程式为
;由F生成一硝化产物的化学方程式为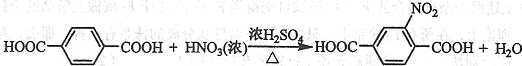 ,该产物的名称是2-硝基-1,4-苯二甲酸(或硝基对苯二甲酸).
,该产物的名称是2-硝基-1,4-苯二甲酸(或硝基对苯二甲酸).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 图是研究甲烷与氯气反应的实验装置图
图是研究甲烷与氯气反应的实验装置图查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 第2周期 | ⑦ | ⑧ | ||||||
| 第3周期 | ① | ③ | ⑤ | ④ | ⑨ | ⑩ | ||
| 第4周期 | ② | ⑥ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素的葡萄糖单元中含有羟基 | |
| B. | 氨基酸分子中既有氨基,又有羧基,属于两性化合物 | |
| C. | CH3CO18OH和C2H5OH发生酯化反应的有机产物是CH3CO18OC2H5 | |
| D. | 用甘氨酸(H2N-CH2-COOH)和丙氨酸( )缩合最多可形成4种二肽 )缩合最多可形成4种二肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热的反应一定是吸热反应 | |
| B. | 反应是放热还是吸热需要看反应物和生产物所具有的总能量的相对大小 | |
| C. | 放热反应在常温下一定很容易发生 | |
| D. | 化学反应都伴随能量变化,而且都表现为热量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ•mol-1,甲醚可作燃料电池的燃料.
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ•mol-1,甲醚可作燃料电池的燃料.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com