
 ?2NH3(g)””¦¤H£¼0£¬·“Ó¦¹ż³ĢČēĶ¼£ŗĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
?2NH3(g)””¦¤H£¼0£¬·“Ó¦¹ż³ĢČēĶ¼£ŗĻĀĮŠĖµ·ØÕżČ·µÄŹĒ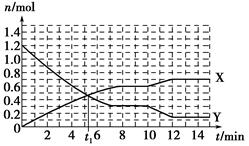
| A£®t1 minŹ±Õż”¢Äę·“Ó¦ĖŁĀŹĻąµČ”£ |
| B£®XĒśĻß±ķŹ¾NH3µÄĪļÖŹµÄĮæĖꏱ¼ä±ä»ÆµÄ¹ŲĻµ |
C£®0”«8 min£¬H2µÄĘ½¾ł·“Ó¦ĖŁĀŹv(H2)£½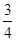 mol”¤L£1”¤min£1 mol”¤L£1”¤min£1 |
| D£®10”«12 min£¬ÉżøßĪĀ¶ČŹ¹·“Ó¦ĖŁĀŹ¼Óæģ£¬Ę½ŗāÕżĻņŅĘ¶Æ |



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 CH3OCH3(g)£«H2O(g)
CH3OCH3(g)£«H2O(g)| ČŻĘ÷ ±ąŗÅ | ĪĀ¶Č£Ø”ę£© | ĘšŹ¼ĪļÖŹµÄĮæ£Ømol£© | Ę½ŗāĪļÖŹµÄĮæ£Ømol£© | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.20 | 0.080 | 0.080 |
| ¢ņ | 387 | 0.40 | | |
| ¢ó | 207 | 0.20 | 0.090 | 0.090 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
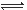 2Z(g)£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ (””””)
2Z(g)£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ (””””)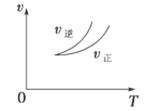
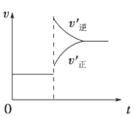
| A£®×óÉĻĶ¼ĖµĆ÷Õż·“Ó¦ĪŖĪüČČ·“Ó¦ |
| B£®·“Ó¦“ļĘ½ŗāŗó£¬Ōö“óŃ¹ĒæĘųĢåĆÜ¶Č½«¼õŠ” |
| C£®ÓŅÉĻĶ¼æɱķŹ¾ÉżøßĪĀ¶ČŹ¹Ę½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ |
| D£®ÓŅÉĻĶ¼ŠéĻßæɱķŹ¾Ź¹ÓĆ“ß»Æ¼ĮŗóŅż·¢µÄ·“Ó¦ĖŁĀŹ±ä»Æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 2CO(g)+2H2(g)”””÷H£½”” ””kJ”¤mol£1
2CO(g)+2H2(g)”””÷H£½”” ””kJ”¤mol£1 2CO(g)+2H2(g)£¬²āµĆCH4µÄĘ½ŗā×Ŗ»ÆĀŹÓėĪĀ¶Č”¢Ń¹ĒæµÄ¹ŲĻµČēĻĀĶ¼ĖłŹ¾”£
2CO(g)+2H2(g)£¬²āµĆCH4µÄĘ½ŗā×Ŗ»ÆĀŹÓėĪĀ¶Č”¢Ń¹ĒæµÄ¹ŲĻµČēĻĀĶ¼ĖłŹ¾”£
 CO(g)+H2 (g)Ą“ÖĘČ””£
CO(g)+H2 (g)Ą“ÖĘČ””£| A£®ĢåĻµŃ¹Ēæ²»ŌŁ±ä»Æ | B£®H2ÓėCOµÄĪļÖŹµÄĮæÖ®±ČĪŖ1:1 |
| C£®»ģŗĻĘųĢåµÄĆܶȱ£³Ö²»±ä | D£®ĘųĢåĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæĪŖ15£¬ĒŅ±£³Ö²»±ä |

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 2CĄ“Ėµ£¬ĻĀĮŠ·“Ó¦ĖŁĀŹ×īæģµÄŹĒ£ŗ£Ø £©
2CĄ“Ėµ£¬ĻĀĮŠ·“Ó¦ĖŁĀŹ×īæģµÄŹĒ£ŗ£Ø £© ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĪŹ“šĢā
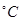 Ź±£¬ŌŚ2LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ³äČė2molNOŗĶ1molO2·¢Éś·“Ó¦£¬2NO(g)+O2(g)
Ź±£¬ŌŚ2LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ³äČė2molNOŗĶ1molO2·¢Éś·“Ó¦£¬2NO(g)+O2(g) 2NO2(g)£¬¾5min“ļµ½Ę½ŗā£¬²āµĆc£ØNO)="0.5" mol/L£¬²¢·ÅČČQkJ”£5minÄŚ v(O2)=___________”£
2NO2(g)£¬¾5min“ļµ½Ę½ŗā£¬²āµĆc£ØNO)="0.5" mol/L£¬²¢·ÅČČQkJ”£5minÄŚ v(O2)=___________”£ 2NO2(g)µÄ”÷H= ”£
2NO2(g)µÄ”÷H= ”£²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| t / s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3) / mol | 0 | 0. 16 | 0. 19 | 0. 20 | 0. 20 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
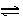 2NH3£¬ŌŚ2LĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬5minÄŚ°±µÄÖŹĮæŌö¼ÓĮĖ1.7g£¬Ōņ·“Ó¦ĖŁĀŹĪŖ
2NH3£¬ŌŚ2LĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬5minÄŚ°±µÄÖŹĮæŌö¼ÓĮĖ1.7g£¬Ōņ·“Ó¦ĖŁĀŹĪŖ| A£®v(H2)=0.03mol/(L”¤min) | B£®v(N2)="0.005mol/(L”¤min)" |
| C£®v(NH3)=0.17mol/(L”¤min) | D£®v(NH3)=0.02mol/(L”¤min) |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 cC£Øg£©£«dD£Øg£©¦¤HĶ¬Ź±·ūŗĻĻĀĮŠĮ½Ķ¼ÖŠø÷ĒśĻߵĹęĀɵÄ( )
cC£Øg£©£«dD£Øg£©¦¤HĶ¬Ź±·ūŗĻĻĀĮŠĮ½Ķ¼ÖŠø÷ĒśĻߵĹęĀɵÄ( )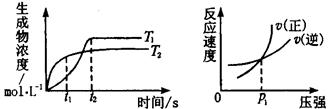
| A£®a£«b£¾c£«d T1£¼T2 ¦¤H£¼0 |
| B£®a£«b£¾c£«d T1£¼T2 ¦¤H£¾0 |
| C£®a£«b£¼c£«d T1£¾T2 ¦¤H£¼0 |
| D£®a£«b£¾c£«d T1£¾T2 ¦¤H£¾0 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com