
| A. | F、O、N非金属性依次减弱,HF、H2O、NH3沸点依次降低 | |
| B. | Li、Na、K、Rb、Cs的失电子能力逐渐增强 | |
| C. | Al3+、Mg2+、Na+的离子半径依次增大 | |
| D. | HF、HCl、HBr、HI稳定性依次减弱,还原性依次增强 |
分析 A、HF、H2O、NH3中均存在氢键,据此解答即可;
B、元素的金属性越强,失电子能力越强;
C、核外电子排布相同的离子,原子序数越大,半径越小;
D、元素的非金属性越强,其对应氢化物越稳定,还原性越弱.
解答 解:A、HF、H2O、NH3中均存在氢键,每个水分子可以形成2个氢键,故水的沸点最高,故A错误;
B、元素的金属性越强,其越容易失去电子,故B正确;
C、核外电子排布相同的离子,原子序数越大,半径越小,故Al3+、Mg2+、Na+的离子半径依次增大正确,故C正确;
D、元素的非金属性越强,其对应氢化物越稳定,还原性越弱,由于分金属性F>Cl>Br>I,故HF、HCl、HBr、HI稳定性依次减弱,还原性依次增强正确,故D正确,故选A.
点评 本题考查元素周期律知识,题目难度不大,本题注意元素的非金属性、金属性与元素对应单质、化合物的关系.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 核素是指质量数相同的微粒 | |
| B. | 核素是指 质子数相同、中子数不同的微粒 | |
| C. | 核素是指具有一定数目的质子和一定数目的中子的一种原子 | |
| D. | 核素是指质子数相同、核外电子数不同的微粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应生成的NH3速率和逆反应生成N2的速率相等 | |
| B. | 反应器中压强不随时间变化而变化 | |
| C. | 1molN≡N键断裂的同时,有6molN-H键断裂 | |
| D. | 混合气体平均分子量保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 单体为CH2═CH-Cl.
单体为CH2═CH-Cl. 单体为CH2═CH-CH═CH2,
单体为CH2═CH-CH═CH2, 单体为
单体为 ,
, 单体为HO-CH2CH2-OH和HOOC-COOH.
单体为HO-CH2CH2-OH和HOOC-COOH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 只有干燥的布条褪色 | B. | 只有湿润的布条褪色 | ||
| C. | 两块布条均褪色 | D. | 两块布条均不褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NO2) | B. | c(N2O4) | C. | $\frac{c(N{O}_{2})}{c({N}_{2}{O}_{4})}$ | D. | $\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫代硫酸钠(Na2S2O3•5H2O)是一种脱氯剂,它易溶于水,难溶于乙醇,40~45℃熔化,48℃分解,由硫化钠和亚硫酸钠制备,涉及的反应原理为:
硫代硫酸钠(Na2S2O3•5H2O)是一种脱氯剂,它易溶于水,难溶于乙醇,40~45℃熔化,48℃分解,由硫化钠和亚硫酸钠制备,涉及的反应原理为: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
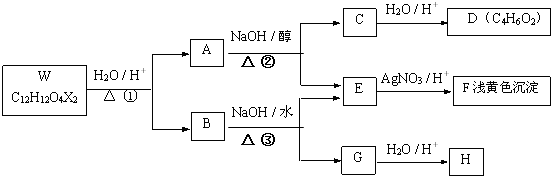

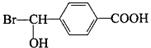
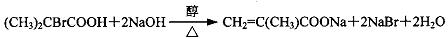
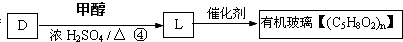 ,反应④的化学方程式是
,反应④的化学方程式是
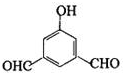 、
、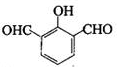 、
、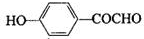 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com