
【题目】下列有关物理量相应的单位表达错误的是( )
A. 摩尔质量g/molB. 气体摩尔体积L/mol
C. 阿伏伽德罗常数 mol / NAD. 密度g/cm3
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1 mol ![]() 中,电子的物质的量为11 mol
中,电子的物质的量为11 mol
B. 将4g NaOH溶解于1 L水中所得溶液物质的量浓度为1 mol·L![]()
C. 等质量的臭氧(O![]() )与氧气所含的原子数相等
)与氧气所含的原子数相等
D. 标准状况下1mol任何物质体积均约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL 0.1 mol/L的![]() 溶液中加入100mL溶有2.08 g
溶液中加入100mL溶有2.08 g ![]() 的溶液,再加入100mL溶有0.01mol
的溶液,再加入100mL溶有0.01mol ![]() ·
·![]() 的溶液,充分反应(
的溶液,充分反应(![]() 微溶,AgCl、
微溶,AgCl、![]() 比
比![]() 更易沉淀)。下列说法中正确的是
更易沉淀)。下列说法中正确的是
A. 最终得到白色沉淀和无色溶液
B. 最终得到的白色沉淀是等物质的量的两种化合物的混合物
C. 在最终得到的溶液中, ![]()
D. 在最终得到的溶液中, ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)Fe3+具有氧化性,实验室测定含碘废液中I﹣的含量的过程如下:量取25.00mL废液于250mL锥形瓶中,分别加入5mL 2molL﹣1 H2SO4和10mL 20% Fe2(SO4)3溶液,摇匀.小火加热蒸发至碘完全升华,取下锥形瓶冷却后,加入几滴二苯胺磺酸钠(用作指示剂),用0.02500molL﹣1标准K2Cr2O7溶液进行滴定到终点.重复3次,数据记录如表:
次数 | 1 | 2 | 3 |
滴定体积/mL | 19.98 | 20.02 | 19.00 |
(i)在盛有废液的锥形瓶中先加入5mL 2molL﹣1 H2SO4的目的是 . (用离子方程式和语言叙述解释)
(ii)上述过程中涉及的反应:①2Fe3++2I﹣═2Fe2++I2② .
(iii)根据滴定有关数据,该废液中I﹣含量是gL﹣1 .
(iv)在滴定过程中,下列操作(其他操作正确)会造成测定结果偏低的是 .
A.终点读数时俯视读数,滴定前平视读数
B.锥形瓶水洗衣后未干燥
C.滴定管未用标准K2Cr2O7溶液润洗
D.盛标准K2Cr2O7溶液的滴定管,滴定前有气泡,滴定后无气泡.
(2)Fe3+和Ag+的氧化性相对强弱一直是实验探究的热点.某学习小组同学设计如下实验:
实验编号 | 实验操作 | 现象 |
1 | 向10mL 3mol/L KNO3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 无白色沉淀生成 |
2 | 向10mL 1mol/L AgNO3溶液中滴加2mL 0.1mol/L FeSO4溶液,振荡,再滴加酸性KMnO4溶液 | 紫红色不褪去 |
3 | 向10mL 1mol/L Fe(NO3)3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 有白色沉淀生成 |
请回答:
(i)设计实验①的目的是 .
(ii)实验③可得出结论是 .
(iii)写出实验②中反应的离子方程式
(iv)根据以上实验,Fe3+和Ag+的氧化性相对强弱与离子有关.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4 . H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4H2O+NaCl.据此,某学生设计了下列实验.
(1)【制备NaClO溶液】实验装置如图甲所示(部分夹持装置已省略)
已知:3NaClO ![]() 2NaCl+NaClO3
2NaCl+NaClO3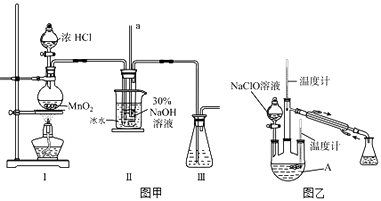
(i)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有(填字母).
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(ii)装置工中发生的离子反应方程式是;Ⅱ中玻璃管a的作用为;为了提高NaClO的产率,需对I中产生的Cl2进行净化,所用试剂是;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的
(2)【制取水合肼】实验装置如图乙所示
仪器A的名称为;反应过程中,如果分液漏斗中溶液的滴速过快,部分N2H4H2O参与A中反应并产生大量氮气,产品产率因此降低,请
写出降低产率的相关化学反应方程式;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品.
(3)【测定肼的含量】
称取馏分0.3000g,加水配成20.0mL溶液,在一定条件下,用0.1500molL﹣1 的I2溶液滴定.
已知:N2H4H2O+2I2=N2↑+4Hl+H2O.
①滴定时,可以选用的指示剂为;
②实验测得消耗I2溶液的平均值为20.00mL,馏分中N2H4 . H2O的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年,我国女药学家屠呦呦因发现了青蒿素( C15H22Os)而获得诺贝尔奖,青蒿素的一种化学合成路线如图: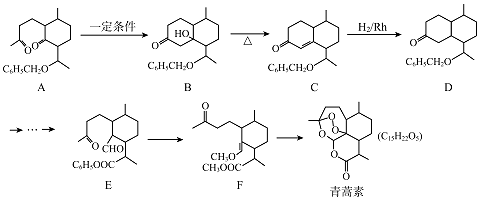
(1)化合物D的分子式为 , D中含有的官能团名称是 .
(2)合成A常用到原料 ![]() ,现有相对分子质量最小的该原料的同系物X,检验X中碳碳双键的操作方法 , 写出X与银氨溶液发生的离子反应方程式 .
,现有相对分子质量最小的该原料的同系物X,检验X中碳碳双键的操作方法 , 写出X与银氨溶液发生的离子反应方程式 .
(3)B﹣C的反应类型为 .
(4)E﹣F的过程中常用HSCH2CH2CH2SH对E进行官能团保护,含﹣SH(巯基)叫硫醇,根据系统命名法,HSCH2CH2CH2SH的名称是
(5)同时满足以下条件的青蒿素的同分异构体共有种.
①常温下,能与NaHCO3溶液反应;②能与FeCl3溶液发生显色反应;③1mol该物质与足量的Na反应,产生2mol H2;④质谱与红外表明分子中含2个 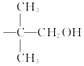 基团;
基团;
⑤苯环上只有一种化学环境的氢.
(6)参考上述合成路线,写出由苯甲醛和乙醇为原料,经三步制备3﹣苯基丙烯醛的合成路线(无机试剂任选). 合成路线示例是:CH2=CH2 ![]() CH3CH2Br
CH3CH2Br ![]() CH3CH2OH.
CH3CH2OH.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究浓硫酸和铜的反应,下列装置或操作正确的是( )
A.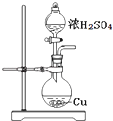
用装置进行铜和浓硫酸的反应
B.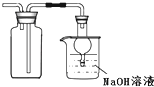
用装置收集二氧化硫并吸收尾气
C.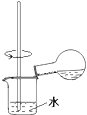
用装置稀释反应后的混合液
D.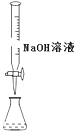
用装置测定余酸的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知MnO2和浓盐酸加热可以制取Cl2,某化学研究性学习小组拟用下列装置和药品制备无水氯化铁晶体,该物质极易潮解,100℃左右时升华。

请回答下列问题
(1)制备开始时A 装置烧瓶中产生的现象为_____;发生反应的离子 方程式为_____________________。
(2)按气流方向连接完整转置:a→___→___→___→___→b→c→___→___(填仪器接口字母编号)。____
(3)装置E的作用是_______;B装置硬质政璃管内导管口处棉花的作用是_________________。
(4)若无C装置可能产生的后果是________________________________。
(5)本实验合理的操作步骤为_____________________________(按操作顺序选择序号)
①添加药品②连接仪器③检查装置气密性④点燃A处酒精灯⑤点燃B处酒精灯⑥使B中硬质玻璃管内充满黄绿色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中的少量杂质(括号内),选用的试剂和分离方法不能达到实验目的是( )
混合物 | 试剂 | 分离方法 | |
A | 粗苯甲酸(泥沙等) | 水 | 重结晶 |
B | 甲烷(乙烯) | 高锰酸钾酸性溶液 | 洗气 |
C | 乙炔(硫化氢) | 硫酸铜溶液 | 洗气 |
D | 溴苯(溴) | 稀氢氧化钠溶液 | 分液 |
A.A
B.B
C.C
D.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com