
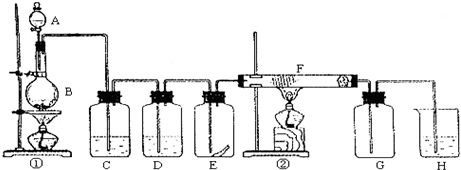
| ||


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
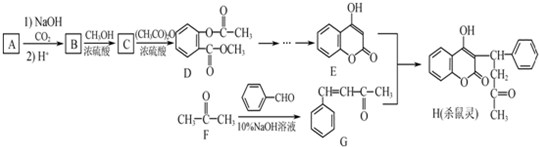
 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:| NaOH醇溶液 |
| △ |
| H2 |
| Ni/△ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+(Fe2+),加过量铁粉,过滤 |
| B、Mg2+(Al3+),加过量氨水,过滤 |
| C、CO2(HCl),通过碳酸钠饱和溶液,洗气 |
| D、固体Na2CO3(NaHCO3),加热至恒重 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 .
.


| O2 |
| 催化剂 |
| CH3CH2OH |
| 浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
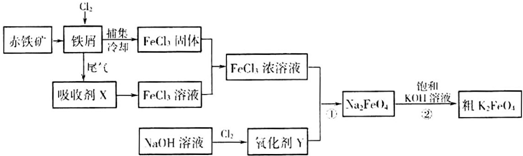
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
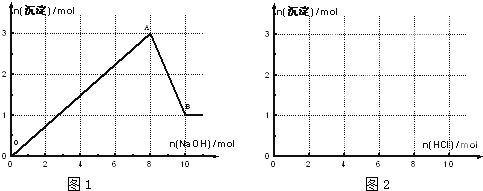
查看答案和解析>>
科目:高中化学 来源: 题型:
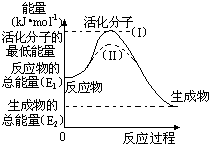 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察如图,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察如图,然后回答问题.| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com