
将SO2通入显红色的酚酞试剂中,发现红色消失,主要是因为SO2( )
A.有漂白性 B.有还原性
C.溶于水后显酸性 D.有氧化性
科目:高中化学 来源: 题型:
如图所示,室温下向盛有3.0 mL NO的试管中缓缓通入1.5 mL O2(所有气体体积均在标准状况下测定)。

试回答下列问题:
(1)写出观察到的现象(可不写满,也可补充):
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
(2)最终试管中剩余的气体是________,体积为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y是除第一周期外的短周期元素,它们可以形成离子化合物XmYn,且离子均具有稀有气体原子的结构,若X的原子序数为a,则Y 的核电荷数不可能是:
A.a—34+m+n B.a+16—m—n C.a+8—m—n D.a—m—n
查看答案和解析>>
科目:高中化学 来源: 题型:
按下图所示的装置进行实验:
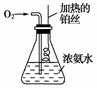
(1)实验开始一段时间后,可观察到锥形瓶瓶口上方有白烟生成,请补充可能观察到的其他现象:______________________________________________;
有关化学方程式为__________________________________________________。
(2)由于气温的原因,上述实验一段时间后现象不太明显,需要向锥形瓶内加入下列哪种物质才能重新看到明显的现象?________。
A.NaOH B.CaO
C.浓H2SO4 D.NH4Cl
(3)经过对比实验证明,在其他条件相同时,用空气代替氧气的实验效果较差,主要原因是________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是实验室制备SO2并验证SO2某些性质的装置图。

试回答:
(1)⑥中发生反应的化学方程式为__________________________________ ________________________________________________________。
(2)①中的实验现象为______________,此实验证明SO2是________气体。
(3)②中的品红溶液________,证明SO2有________性。
(4)③中的实验现象是__________,证明SO2有________性。
(5)④中的实验现象是__________,证明SO2有________性。
(6)⑤的作用是__________________________,化学方程式为
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是(双选)( )

A.洗气瓶中产生的沉淀是碳酸钡
B.在Z导管出来的气体中无二氧化碳
C.洗气瓶中产生的沉淀是硫酸钡
D.在Z导管口有红棕色气体出现
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的量的说法正确的是( )
A.物质的量就是物质的质量
B.摩尔是国际单位制中的基本单位
C.某容器中有1 mol氯
D.阿伏加德罗常数是6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生用0.1000mol/LKOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如
下几步
A 移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
B 用标准溶液润洗滴定管2-3次
C 把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
E.调节液面至0或0刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面刻度
(1) 正确操作的顺序是(用序号字母填写) B- 。
(2) 滴定开始后,眼睛注视 ,判断滴定终点的现象是:
(3) 下列操作中可能使所测盐酸的浓度数值偏高的是
A 碱式滴定管未用标准溶液润洗就直接注入标准液
B 滴定前盛放HCl的锥形瓶用蒸馏水洗净后有少量水残留
C 碱式滴定管在滴定前有气泡,滴定后气泡消失
D 读取氢氧化钠溶液时,开始仰视读数,滴定结束时俯视读数
(4)滴定开始和结束时,碱式滴定管中的液面如图C所示,则终点读数为 mL,所测盐酸溶液的浓度为 mol/L。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com