
| A. | 只有①④ | B. | 只有②③④⑤ | C. | 只有①②③④ | D. | 全部 |
分析 ①Na、②Na0H、③Na2O、④Na2O2、⑤Na2CO3•10H20都不稳定,在空气最终生成Na2CO3,以此解答该题.
解答 解:①Na在空气中不稳定,易生成Na2O、Na0H,最终生成Na2CO3;
②Na0H与二氧化碳反应最终生成Na2CO3;
③Na2O与空气中水、二氧化碳反应最终生成Na2CO3;
④Na2O2与空气中水、二氧化碳反应最终生成Na2CO3;
⑤Na2CO3•10H20不稳定,可风化,在空气最终生成Na2CO3,
故选D.
点评 本题综合考查钠及其化合物的性质,为高频考点,侧重于学生的分析能力以及元素化合物的综合理解和运用的考查,注意相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:解答题

 、
、
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
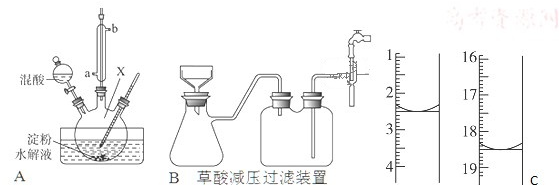
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH和CH3OCH3 | B. | C6H5OH和C6H5CH2OH | ||
| C. | CH3Cl和C3H7Cl | D. | C17H35COOH和C17H33COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com