
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
分析 CO2是酸性氧化物,能和碱反应;
MgO是碱性氧化物,能和酸反应;
Na2SO4是盐,能发生复分解反应;
Ba(OH)2是碱,能发生复分解反应;
盐酸是HCl的水溶液,可以发生复分解反应,以此解答该题.
解答 解:CO2是酸性氧化物,能和碱反应,故能和Ba(OH)2反应;
MgO是碱性氧化物,能和酸反应,故可以和盐酸反应;
Na2SO4是盐,能与Ba(OH)2发生复分解反应;
Ba(OH)2是碱,能和盐酸发生复分解反应;
故能发生的反应有4个.
故选B.
点评 本题综合考查元素化合物知识,为高频考点,侧重考查学生的分析能力,注意把握相关物质的性质,难度不大,题目有利于培养学生良好的科学素养.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Z位于周期表第三周期第ⅦA族 | |
| B. | 简单离子半径由大到小排序:Z、T、X、Y | |
| C. | X、Y、Z的最高价氧化物对应的水化物能相互反应 | |
| D. | R2T2和X2T2中所含化学键类型完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 =2Cr(OH)3↓+3O2↑+2H2O
=2Cr(OH)3↓+3O2↑+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3g | B. | 2.93g | C. | 1.15g | D. | 4.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的还原性:W>Y | |
| B. | 最高价氧化物对应的水化物的酸性:X>Z | |
| C. | W的阳离子和Z的阴离子均能促进水的电离 | |
| D. | 由W、Y、Z三种元素组成的化合物既含离子键又含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
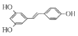 )具有预防心血管疾病的作用,其一种合成路线如图:
)具有预防心血管疾病的作用,其一种合成路线如图: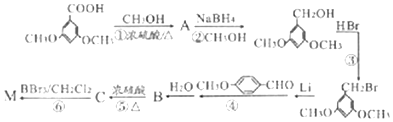
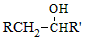
 $\stackrel{BBr_{3}/CH_{2}Cl_{2}}{→}$
$\stackrel{BBr_{3}/CH_{2}Cl_{2}}{→}$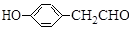 回答下列问题:
回答下列问题: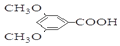 核磁共振氢谱中不同化学环境的氢原子个数比为6:1:2:1.
核磁共振氢谱中不同化学环境的氢原子个数比为6:1:2:1. .
. .
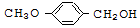
.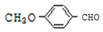 有多种同分异构体,其中能发生银镜反应且苯环上一氯取代物只有两种的同分异构体有3种.
有多种同分异构体,其中能发生银镜反应且苯环上一氯取代物只有两种的同分异构体有3种.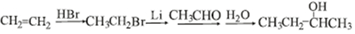 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 表中表示的一些物质或概念间的从属关系中不正确的是( )
表中表示的一些物质或概念间的从属关系中不正确的是( )| X | Y | Z | ||
| 例 | 氧化物 | 化合物 | 纯净物 | |
| A | 苯的同系物 | 芳香烃 | 芳香化合物 | |
| B | 烯烃 | 不饱和烃 | 烃 | |
| C | 氯乙烷 | 卤代烃 | 烃的衍生物 | |
| D | 羰基 | 羧基 | 酯基 | |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu$\stackrel{浓硝酸}{→}$Cu(NO3)2 | |
| B. | Cu$\stackrel{稀硝酸}{→}$Cu(NO3)2 | |
| C. | Cu$→_{△}^{O_{2}}$CuO$\stackrel{硝酸}{→}$Cu(NO3)2 | |
| D. | Cu$→_{△}^{浓硫酸}$CuSO4$\stackrel{Ba(NO_{3})_{2}}{→}$Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质的量/时间 | n(N2H4) | n(NO2) | n(N2) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.3 |
| 第5min | 0.4 | 1.2 | 0.6 |
| 第6min | 0.4 | 1.2 | 0.6 |
| 第10min | 0.6 | 1.4 | 0.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com