
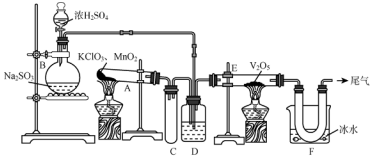
分析 B装置制备二氧化硫,A装置制备氧气,经D装置干燥后在E装置反应生成三氧化硫,F装置收集制备的三氧化硫,最后尾气处理,
(1)装置B中为亚硫酸钠与浓硫酸制备二氧化硫的反应;
(2)小试管的作用为防倒吸;
(3)依据通入E装置,D中应放入浓硫酸.作用①干燥SO2;②使SO2和O2两种气体混合均匀;③通过观察气泡控制气体比例和气流速度;
(4)E装置中SO2与O2催化氧化反应;
(5)根据SO3在0℃时凝结为固态分析;
(6)根据浓硫酸与H2S气体反应;
(7)尾气的成分为二氧化硫,酸性气体,选择碱液氢氧化钠吸收.
解答 解:(1)装置B中为亚硫酸钠与浓硫酸制备二氧化硫的反应,化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)小试管C可以作为缓冲瓶,有效防倒吸;
故答案为:防倒吸;
(3)E装置为二氧化硫与氧气催化氧化生成三氧化硫的装置,D中应放入浓硫酸,作用①干燥SO2;②使SO2和O2两种气体混合均匀;③通过观察气泡控制气体比例和气流速度;
故答案为:浓硫酸;干燥SO2;使SO2和O2两种气体混合均匀;
(4)E装置为二氧化硫与氧气催化氧化生成三氧化硫的装置,反应为:SO2+O2$?_{△}^{V_{2}O_{5}}$SO3;
故答案为:SO2+O2$?_{△}^{V_{2}O_{5}}$SO3;
(5)SO3在0℃时凝结为固态,故U形管中所收集物质的成分是三氧化硫;
故答案为:SO3;
(6)浓硫酸与H2S气体反应,则在浓硫酸的作用下不可能有H2S气体,选择b;
故答案为:b;
(7)尾气的成分为二氧化硫,酸性气体,选择碱液吸收,离子方程式为:SO2+2OH-=SO32-+H2O;
故答案为:用碱液吸收SO2;SO2+2OH-=SO32-+H2O.
点评 本题考查了物质制备方案设计,主要考查了化学方程式的书写、实验方案评价、氧化还原反应、环境保护等,题目难度中等,侧重于考查学生的分析问题和解决问题的能量,注意相关基础知识的学习与积累.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016-2017学年四川省成都市高一上10月月考化学试卷(解析版) 题型:选择题
若一氧化碳和二氧化碳的混合气体的密度与同温同压下氧气的密度相同,混合气体中一氧化碳和二氧化碳的物质的量之比是( )
A. 1:3 B. 3:1 C. 2:1 D. 1:2
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(NaOH)=10时,c(OH-)+c(H2C2O4)═c(C2O42-)+c(H+) | |
| B. | V(NaOH)=100 mL时,可能存在c(Na+)>2c(C2O42-)+c(HC2O4-) | |
| C. | V(NaOH)=1000 mL时,c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4) | |
| D. | V(NaOH)=10 mL时,溶液中c(H+)=1×10-12 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液的PH大于1 | |
| B. | c(OH-)=c(H+)-C(CH3COO-) | |
| C. | 与等体积、等浓度的NaOH溶液完全中和后,溶液显中性 | |
| D. | 与足量锌反应比等体积、等浓度的盐酸反应速率慢,生成氢气的质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
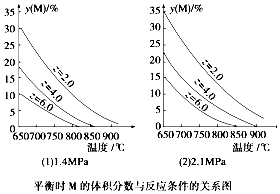
| A. | a+b<c+d | |
| B. | 同温同压时,增加z,平衡时Q的体积分数增加 | |
| C. | 同压同z时,升高温度,气体平均摩尔质量增加 | |
| D. | 同温同z时,增加压强,平衡时Q的物质的量浓度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 1 | C. | 0.5 | D. | 0.25 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com