
【题目】乙烷(C2H6)作为一种新能源在化学领域应用广泛,请回答下列问题:(如图所示,装置Ⅰ为乙烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
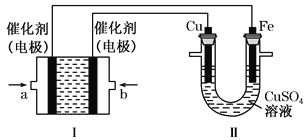
①a处应通入______(填“C2H6”或“O2”),a处电极上发生的电极反应式是____________________________________;
②电镀结束后,装置Ⅰ中溶液的pH______(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度______;
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有___________(忽略水解);在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗乙烷________L(标准状况下)。
【答案】 C2H6 C2H6-14e-+18OH-=2CO32-+12H2O 变小 不变 CO32- 0.64
【解析】试题分析:本题考查乙烷燃料电池,电镀原理以及多池串联装置的计算。装置II实现铁棒上镀铜,根据电镀原理,则Fe为阴极,Cu为阳极,Fe极与a极相连,Cu极与b极相连,a极为负极,b极为正极。
①乙烷燃料电池中,通入乙烷的一极为负极,通入O2的一极为正极,a处应通入C2H6。由于电解质溶液为KOH溶液,a处C2H6发生氧化反应生成CO32-,1molC2H6失去14mol电子,a处的电极反应式为C2H6-14e-+18OH-=2CO32-+12H2O。
②装置I中电池总反应为2C2H6+7O2+8OH-=4CO32-+10H2O,OH-浓度减小,pH变小。装置II中Cu极的电极反应式为Cu-2e-=Cu2+,Fe极的电极反应式为Cu2++2e-=Cu,装置II中Cu2+的物质的量浓度不变。
③根据装置I中的电池总反应,电镀结束后装置I溶液中的阴离子除了OH-外还含有CO32-。装置II中阴极电极反应为Cu2++2e-=Cu,装置I中负极反应式为C2H6-14e-+18OH-=2CO32-+12H2O,根据电子守恒,2n(Cu)=14n(C2H6),n(C2H6)=![]() n(Cu)=
n(Cu)=![]() =
=![]() mol,消耗乙烷在标准状况下的体积为
mol,消耗乙烷在标准状况下的体积为![]() mol
mol![]() 22.4L/mol=0.64L。
22.4L/mol=0.64L。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】金刚烷是一种重要的化工原料,工业上可通过下列途径制备:

请回答下列问题:
(1)环戊二烯分子中最多有 __________个原子共平面;
(2)金刚烷的分子式为 ____________ ;
(3)下面是以环戊烷为原料制备环戊二烯的合成路线:

其中,反应①的产物名称是 __________,反应②的反应试剂和反应条件是 __________。
(4)已知烯烃能发生如下反应:

请写出下列反应产物的结构简式:
![]()
![]() ____________________________________。
____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来雾霾天气经常肆虐北京、天津、河北等地区,其中汽车尾气和燃煤是造成空气污染的原因之一。因此研究氮氧化物的反应机理,对消除和防治环境污染有重要意义。
(1) 对于2NO(g) + 2H2(g) = N2(g) + 2H2O(g) △H = 665 kJ/mol 的反应分三步完成:
① 2NO(g) = N2O2(g) (快)
② N2O2(g) + H2(g) = N2O(g) + H2O(g) (慢)
③ ______________________________ (快),请完成第③步的化学方程式。因此决定此总反应速率的是第_____步的反应。(填序号)
(2) 已知:H2(g) + CO2(g) = H2O(g) + CO(g) △H = + 41 kJ/mol汽车尾气的净化原理主要是用催化剂把NO与CO反应转化为两种对大气无污染的气体,试写出该反应的热化学方程式:______________。
该反应在一定条件下达到平衡后,为了能加快反应速率并让反应向正方向移动,可采取的措施有:(__________)
A.适当升高温度 B.适当降低温度 C.压缩体积增大压强 D.使用正催化剂
该反应采取上述措施重新达到平衡后K值将______(填“增大”、“减小”和“不变”)
(3) 升高温度能让绝大多数的化学反应加快反应速率,但是研究发现2NO(g) + O2(g) = 2NO2(g) △H < 0 存在一些特殊现象。现有某化学小组通过实验测得不同温度下该反应速率常数k (代表反应速率的一个常数)的数值如下表:
T(K) | k | T(K) | k | T(K) | k |
143 | 1.48 × 105 | 273 | 1.04 × 104 | 514 | 3.00 × 103 |
195 | 2.58 × 104 | 333 | 5.50 × 103 | 613 | 2.80 × 103 |
254 | 1.30 × 104 | 414 | 4.00 × 103 | 663 | 2.50 × 103 |
由实验数据测到v(正)~c(O2)的关系如图所示,当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为_____点(填字母),并解析原因:①__________,②__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________
A. KMnO4 B. H2O2 C. Cl2 水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)(已知lg2=0.3)
(3)同学们用0.1000 mol·L-1的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量,反应原理为2MnO4-+5H2O2+6H+===2Mn2++8H2O+5O2↑。
①滴定到达终点的现象是______________________________________。
②用移液管吸取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗的酸性KMnO4标准溶液体积如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 17.00 | 16.90 |
则试样中过氧化氢的浓度为___________mol·L-1。
③若滴定前尖嘴中有气泡,滴定后消失,则测定结果______(填“偏低”、“偏高”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为2Cu+Ag2O===Cu2O+2Ag,下列有关说法正确的是 ( )

A. 2 mol Cu与1 mol Ag2O的总能量低于1 mol Cu2O与2 mol Ag具有的总能量
B. 负极的电极反应式为2Cu+2OH--2e-===Cu2O+H2O
C. 测量原理示意图中,电流方向从Cu→Ag2O
D. 电池工作时,OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解Na2CO3溶液制取NaHCO3溶液和NaOH溶液的装置如下图所示。下列说法中,不正确的是

A. 阴极产生的物质A是H2
B. 溶液中Na+由阳极室向阴极室迁移
C. 阳极OH﹣放电,H+浓度增大,CO32-转化为HCO3-
D. 物质B是NaCl,其作用是增强溶液导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是重要的有机化工原料,可由乙烯水合法生产,反应的化学方程式如下:C2H4(g) + H2O(g) ![]() C2H5OH(g) ,下图为乙烯的平衡转化率与温度(T)、压强(P)的关系[起始n(C2H4) : n(H2O) =1:1]。
C2H5OH(g) ,下图为乙烯的平衡转化率与温度(T)、压强(P)的关系[起始n(C2H4) : n(H2O) =1:1]。

下列有关叙述正确的是
A. Y对应的乙醇的物质的量分数为![]()
B. X、Y、Z对应的反应速率:υ(X) >υ(Y) >υ(Z)
C. X、Y、Z对应的平衡常数数值:KX < KY <KZ
D. 增大压强、升高温度均可提高乙烯的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示物质结构的化学用语或说法中,正确的是( )
A. 氮气分子的电子式是:N::N:
B. 苯的结构简式是C6H6
C. 中子数为18的氯原子符号是18Cl
D. 用电子式表示NaCl的形成过程是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。在下列三种晶体①金刚石 ②晶体硅 ③碳化硅中它们的熔点,从高到低的顺序是( )
A. ①③② B. ②③① C. ③①② D. ②①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com