
【题目】下列说法中不正确的是( )
A.欲实现铁片镀锌,用锌作阴极
B.电解精炼铜,若转移2mol电子,阴极质量增加64g
C.硫酸工业中采用沸腾炉以增加固、气接触面积,加快反应速率
D.工业上常用电解熔融氯化钠法制备金属钠
科目:高中化学 来源: 题型:
【题目】在pH=12的无色溶液中能大量共存的离子组是( )
A.NH4+、Mg2+、SO42-、Cl-B.Ba2+、K+、OH-、 NO3-
C.Al3+、Cu2+、SO42-、Cl-D.Na+、Ca2+、Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的两份锌粉a、b,分别加入两支相同的试管中,然后加入等体积等物质的量浓度且均过量的稀硫酸,同时向a中加入少量CuSO4溶液,则产生氢气的体积(V)与时间(t)的关系用图像表示如下,其中正确的是( )
A. 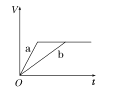 B.
B. 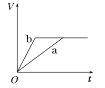 C.
C. 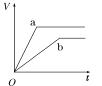 D.
D. 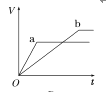
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为V L的密闭容器中进行反应:aN(g) ![]() bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
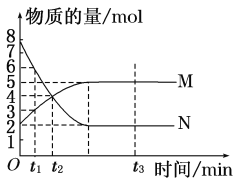
(1)此反应的化学方程式中a∶b=________。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为________。
(3)下列叙述中能说明上述反应达到平衡状态的是________________________________________________________________________。
A.反应中M与N的物质的量之比为1∶1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的转化率达到最大,且保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g) + I2(g)![]() 2HI(g) ΔH=-a kJ·mol-1
2HI(g) ΔH=-a kJ·mol-1
已知: (a、b、c均大于零)
(a、b、c均大于零)
下列说法不正确的是( )
A. 反应物的总能量高于生成物的总能量
B. 断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量
C. 断开2 mol H-I键所需能量约为(c+b+a) kJ
D. 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业采用氯化铵焙烧菱锰矿制备高纯碳酸锰。已知:菱锰矿的主要成分是MnCO3,其中含Fe、Ca、Mg、Al等元素。焙烧后的产物用浓盐酸酸浸,再对浸出液净化除杂,得到的净化液加入碳酸氢铵溶液生成沉淀,洗涤干燥后即可得到产品。回答:
(1)焙烧过程中产生两种气体,一种可使湿润的蓝色石蕊试纸变红,另一种可使湿润的红色石蕊试纸变蓝。请写出焙烧过程中主要反应的方程式______________。
(2)对浸出液净化除杂时,需先加入MnO2将Fe2+转化为Fe3+,写出该反应的离子方程式______________________。检验Fe3+所用试剂的名称是__________。
(3)净化液加入碳酸氢铵溶液时反应的离子方程式为_____________________。
(4)上述生产过程中可循环使用的物质是________。
A.MnCO3 B. HCl C. NH4Cl D. 碳酸氢铵
(5)用滴定法测定浸出液中Mn2+的含量时,需向其中加入稍过量的磷酸和硝酸,加热会生成NO2-。加入稍过量的硫酸铵可以将其转化成无污染的物质而除去,该反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。
(1)利用下图装置电解制备NaOH,两电极区电解液分别为NaOH和NaCl溶液。
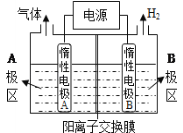
①B极区电解液为__________溶液(填化学式),A极要连接电源的________(填“正”或“负”)极。
②阳极电极反应式为______________________________________,电解过程中Na+向____________电极迁移(填“A”或“B”)。
③电解总反应的离子方程式是_____________________________________________。
(2)利用下图装置,可以模拟铁的电化学防护。
①若X为碳电极,为减缓铁的腐蚀,开关K应置于________处。(填“A”、“B”或“C”)
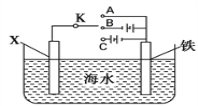
②若X为锌电极,开关K置于A处,该电化学防护法称为______________________。
(3)钒电池是以溶解于一定浓度硫酸溶液中的不同价态的钒离子(V2+、V3+、VO2+、VO2+)为正极和负极电极反应的活性物质,电池总反应为VO2++V3++H2O![]() V2++VO2++2H+。放电时的正极反应式为___________________________充电时的阴极反应式为______________________________。放电过程中,电解液的pH________(选填“升高”“降低”或“不变”)。
V2++VO2++2H+。放电时的正极反应式为___________________________充电时的阴极反应式为______________________________。放电过程中,电解液的pH________(选填“升高”“降低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯亚砜(SOCl2)是一种无色易挥发液体,剧烈水解生成两种气体,常用作脱水剂,其熔点-105℃,沸点79℃,140℃以上时易分解。
(1)用硫黄(S)、液氯和三氧化硫为原料在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量比为______________.
(2)甲同学设计如图装置用ZnCl2 xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并利用装置F验证生成物中的某种气体(夹持及加热装置略)。

①用原理解释SOCl2在该实验中的作用______________________________________;加热条件下,A装置中总的化学方程式为____________________.
②装置的连接顺序为A→B→_____________________;
③实验结束后,为检测ZnCl2 xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为_____________(填序号)
a.加入足量硝酸酸化的硝酸银溶液,充分反应; b.称得固体为n克; c.干燥;d.称取蒸干后的固体m克溶于水;e.过滤;f.洗涤
若m/n=______________(保留小数点后一位),即可证明晶体已完全脱水.
(3)乙同学认为SOCl2还可用作由FeCl3 6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式______________________.
②丙同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3 6H2O于试管中,加入足量SOCl2,振荡使两种物质充分反应;
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
(供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、BaCl2溶液、K3[Fe(CN)6]溶液、溴水)
方案 | 操作 | 现象 | 结论 |
方案一 | 往一支试管中滴加_____________ | 若有白色沉淀生成 | 则发生了上述副反应 |
方案二 | 往另一支试管中滴加 _____________ | __________________ | 则没有发生上述副反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下:

根据设计要求回答:
(1)B装置有三种功能:①控制气流速度; ②均匀混合气体; ③____________。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x取值范围________。
(3)E装置的作用是________(填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(4)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式:_______________________________________。
(5)E装置中除生成盐酸外,还含有有机物,从E中分离出有机物的最佳方法为________。
该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为________(填编号)。
A CH4 B CH3Cl C CH2Cl2 D CHCl3 E CCl4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com