
����Ŀ��С�մ�θ��ƽ���dz��õ��к�θ���ҩ����������գ�
��1��С�մ�ƬÿƬ��0.42gNaHCO3��2ƬС�մ�Ƭ��θ����ȫ�кͣ����к͵����������ʵ�����__mol��
��2��θ��ƽÿƬ��0.195gAl(OH)3���к�θ��ʱ��3ƬС�մ�Ƭ�൱��θ��ƽ__Ƭ��
��3����һ��������þ���Ͻ�Ͷ��100mLһ�����ʵ���Ũ�ȵ������У��Ͻ�ȫ���ܽ⣬��������Һ�еμ�5mol/L��NaOH��Һ�����������ɳ���������������NaOH��Һ�������ϵ��ͼ��ʾ����ͼ�����ݼ��㣺
��ԭ�Ͻ���þ����������___��___��
����������ʵ���Ũ��___��
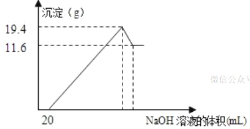
���𰸡�0.01 2 4.8g 2.7g 8mol/L
��������
(1)����̼�����Ƶ��������Ȼ�������ʵ�����
(2)���ݷ���ʽ�ҳ�����������̼������֮��Ĺ�ϵ��
(3)��ͼ��֪���ӿ�ʼ������NaOH��Һ20mL��û�г������ɣ�˵��ԭ��Һ�������ܽ�Mg��Al����ʣ�࣬��ʱ�����ķ�ӦΪ��HCl+NaOH=NaCl+H2O�������μ�NaOH��Һ�������������ʱΪMg(OH)2��Al(OH)3����������֮��Ϊ19.4g����ҺΪ�Ȼ�����Һ���ټ����μ�NaOH��Һ����������ʼ��С����������СʱΪMg(OH)2��������Ϊ11.6g���ʵ����������ʱAl(OH)3������Ϊ19.4g-11.6g=7.8g��
����Ԫ���غ��֪��n(Al)=n[Al(OH)3]��n(Mg)=n[Mg(OH)2]��������m=nM����Al��Mg��������
�ڼ���20mLNaOH��Һ��ǡ���к�ʣ������ᣬ��ʱ��Һ������ΪAlCl3��MgCl2��NaCl��������Ԫ���غ���n(HCl)=3n(AlCl3)+2n(MgCl2)+n(NaCl)��������Ԫ���غ��ʱ��Һ��n(NaCl)=n(NaOH)���ݴ˼����n(HCl)��������c=![]() ������������ʵ���Ũ�ȡ�
������������ʵ���Ũ�ȡ�
(1)�豻�к͵�HCl�����ʵ���Ϊxmol��
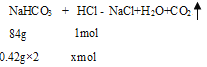
��![]() =
=![]() ����ã�x=0.01��
����ã�x=0.01��
(2)���൱������������Ƭ��Ϊy���ɷ���ʽAl(OH)3+3HCl=AlCl3+3H2O��NaHCO3+HCl�TNaCl+H2O+CO2���ù�ϵʽ��
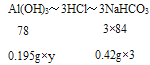
��![]() =
=![]() ����ã�y=2��
����ã�y=2��
(3)��ͼ��֪���ӿ�ʼ������NaOH��Һ20mL��û�г������ɣ�˵��ԭ��Һ�������ܽ�Mg��Al����ʣ�࣬��ʱ�����ķ�ӦΪ��HCl+NaOH=NaCl+H2O�������μ�NaOH��Һ�������������ʱΪMg(OH)2��Al(OH)3����������֮��Ϊ19.4g����ҺΪ�Ȼ�����Һ���ټ����μ�NaOH��Һ����������ʼ��С����������СʱΪMg(OH)2��������Ϊ11.6g���ʵ����������ʱAl(OH)3������Ϊ19.4g-11.6g=7.8g��
����Ԫ���غ��֪��n(Al)=n[Al(OH)3]=![]() =0.1mol������m(Al)=0.1mol��27g/mol=2.7g��
=0.1mol������m(Al)=0.1mol��27g/mol=2.7g��
n(Mg)=n[Mg(OH)2]=![]() =0.2mol������m(Mg)=0.2mol��24g/mol=4.8g��
=0.2mol������m(Mg)=0.2mol��24g/mol=4.8g��
�ڼ���20mLNaOH��Һ��ǡ���к�ʣ������ᣬ��ʱ��Һ������ΪAlCl3��MgCl2��NaCl��������Ԫ���غ���n(HCl)=3n(AlCl3)+2n(MgCl2)+n(NaCl)��������Ԫ���غ��ʱ��Һ��n(NaCl)=n(NaOH)=0.02L��5mol/L=0.1mol������n(HCl)=3n(AlCl3)+2n(MgCl2)+n(NaCl)=3��0.1mol+2��0.2mol+0.1mol=0.8mol��ԭ��������ʵ���Ũ��Ϊ![]() =8mol/L��
=8mol/L��


 ����ѵ�����⿼ϵ�д�
����ѵ�����⿼ϵ�д� �������ϵ�д�
�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������10���л���
��CH4 ��CH3��C![]() CH ��
CH ��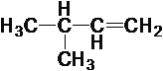 ��
��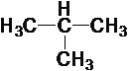 ��
��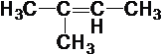 ��
�� ��
��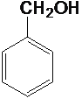 ��
��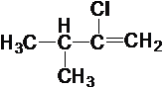 ��
��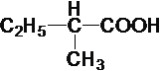 ��C8H18
��C8H18
��ش�����ţ���
��1������Ȳ������____�����ڴ������____��
��2����Ϊͬϵ�����____����Ϊͬ���칹�����____��
��3�����л�������У���ij��̼ԭ��������4����ͬ��ԭ�ӻ�ԭ���ţ�������̼ԭ�ӳ�Ϊ������̼ԭ�������������л����к�������̼ԭ�ӵ���____������û������̼ԭ�ӣ���ͨ�������������ӳɷ�Ӧ���õ����л��ﺬ������̼ԭ�ӵ���___��
��4������������һ��������ϩ���ӳɵõ�����___������Ҳ������ϩ���ӳɵõ������Ľṹ��ʽ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܺϽ��ڴſء��DZ�����������Ҫ��;���ش��������⣺
(1)��̬Coԭ�Ӽ۲���ӵĹ������ʽΪ___________��Co��Ca����ͬһ���ڣ��Һ����������ӹ�����ͬ��������Co���۵�Ƚ���Ca�ĸߣ�ԭ��Ϊ________________��
(2)Pt��Cl�����(![]() )���γ���ͼ��ʾ���ַ��ӡ�
)���γ���ͼ��ʾ���ַ��ӡ�

�����������ͬ����Ԫ�صĵ�һ��������С�����˳��Ϊ________________��
��1mol��������к���![]() ������ĿΪ__________________��
������ĿΪ__________________��
����ͬ�����£����ֻ���������ˮ���ܽ�ȸ����Ϊ__(���)��ԭ��Ϊ____��
(3)ijPt-Co�Ͻ�ľ���ѻ�ģ��Ϊ���������ѻ�������Coԭ�Ӵ��ڶ���λ�á�Ptԭ�Ӵ�������λ�ã���úϽ�Ļ�ѧʽΪ_______��
(4)![]() �����ڼ���ɿ������������ӵ����幹��Ϊ__��̼ԭ�ӵ��ӻ���ʽΪ____��
�����ڼ���ɿ������������ӵ����幹��Ϊ__��̼ԭ�ӵ��ӻ���ʽΪ____��
(5)![]() ��һ�ִ��Բ��ϣ��侧���ṹ��ͼ����ʾ������ͼ��ͼ����ʾ��
��һ�ִ��Բ��ϣ��侧���ṹ��ͼ����ʾ������ͼ��ͼ����ʾ��

��ԭ�����������AΪ(0��0��0)��BΪ(0.31��0.31��0)����Cԭ�ӵ��������Ϊ__��
���������ӵ�������ֵΪ![]() �������ܶ�Ϊ___
�������ܶ�Ϊ___![]() (�г��������ʽ)��
(�г��������ʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ�����CO2���β�����ת��װ����ͼ1������̫���ܵ�أ�װ����ͼ2������ʵ����ɫת���������й�˵��������ǣ� ��

A.c��̫���ܵ�ص�P�缫
B.CO2�����η���������ԭ��Ӧ����CO32-��C2O52-
C.d���缫��ӦʽΪCO32-+4e-=C+3O2-
D.������ת��4mol���ӿɲ����״����CO222.4L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Fe��FeO��Fe2O3��ɵĻ�����м���100mL2mol/L�����ᣬǡ��ʹ�������ȫ�ܽ⣬���ų�448mL���壨��״��������ʱ��Һ����Fe3+���ӣ��������ж���ȷ����
�ٻ�������������ʷ�Ӧʱ������������ʵ���֮��Ϊ1:1:3
�ڷ�Ӧ��������Һ�е�Fe2+������Cl-���ӵ����ʵ���֮��Ϊ1:2
�ۻ�����FeO�����ʵ�����ȷ������Fe��Fe2O3�����ʵ�����
�ܻ�����Fe2O3�����ʵ�����ȷ������Fe��FeO�����ʵ�����
A.�ڢ�B.�٢�C.�ڢ�D.�٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(Na2S2O8)Ҳ�и������ơ����������ƣ��ǰ�ɫ��״��ĩ��������ˮ��������65��ͻᷢ���ֽ⣬����Ư��������������Һ�ۺϴٽ�����ij��ѧС���Na2S2O8�Ʊ������ʽ���̽����
I.ʵ�����Ʊ�Na2S2O8
���������ϣ���ҵ�Ʊ��������Ƶķ�Ӧԭ����
����Ӧ��(NH4)2S2O8+2NaOH![]() Na2S2O8+2NH3��+2H2O
Na2S2O8+2NH3��+2H2O
����Ӧ��2NH3+3Na2S2O8+6NaOH![]() 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
�����ͼʵ��װ�ã�
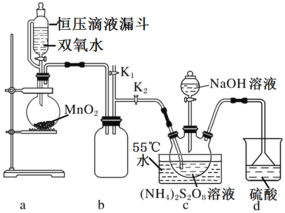
(1)��ѹ��Һ©�����ŵ���___��
(2)װ��a�з�Ӧ������������Ҫ����ͨ��װ��c��Ŀ����___��װ��b��d�����÷ֱ���___��___��
(3)��Ӧ��ϣ�������Բ����ƿ�е���Һ��ѹŨ�����ᾧ���ˡ�ϴ�Ӹ���ɵù������ƣ���ѹŨ����ԭ����___��
II.̽��Na2S2O8������
(1)���Թ���������Һ����Ag+�������¿���Mn2+����ΪMnO4-���÷��������ڼ���Mn2+��������Һ��ȥAg+�����BaCl2��Һ���Բ�����ɫ������
��������Na2S2O8��Һ����Mn2+ʱ��ʵ������Ϊ___��
�ڸ÷�Ӧ�����ӷ���ʽΪ____��
(2)����������Һ��ͭ��Ӧֻ�����������ҷ�Ӧ������죬ijͬѧ�ƲⷴӦ��������ԭ����������ɵ�Cu2+�Է�Ӧ������ã����ʵ�鷽��������Ʋ��Ƿ���ȷ___��(��ѡ���Լ���Cu��Na2S2O8��Һ��Na2SO4��Һ��CuSO4��Һ��Cu(NO3)2��Һ��CuCl2��Һ������ˮ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����600mLij�ֻ������Һ��ֻ���ܺ������������е�������![]()
![]() ��
��![]() ��
��![]() ���ֽ�����Һ�ֳ����ȷݣ���������ʵ��
���ֽ�����Һ�ֳ����ȷݣ���������ʵ��
�����һ���м���AgNO3��Һ���г���������
����ڶ����м�����NaOH��Һ�����Ⱥ��ռ�������0.04 mol����![]() ����Ϊ���ȣ�
����Ϊ���ȣ�
����������м�����BaCl2��Һ�ø���ij���6.27g������������ϴ�ӡ������������Ϊ2.33g��
��������ʵ�飬�����Ʋ������ǣ� ��
A.K+һ������
B.Ba2+��Mg2+һ������
C.Cl- һ������
D.�����Һ��![]() ��Ũ��Ϊ0.1 mol/L
��Ũ��Ϊ0.1 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��Ϊ̽��ͭ��Ũ����ķ�Ӧ������ͼװ�ý����й�ʵ�顣��ش�
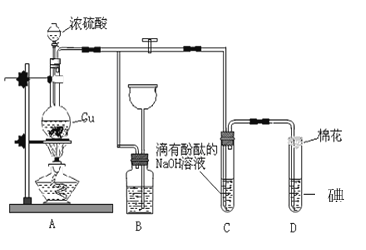
��1��װ��A�з����Ļ�ѧ��Ӧ�Ļ�ѧ����ʽ�� _________________________________��
��2��װ��B ��������__________________��B�й��ƿ��Ӧʢ�ŵ�Һ����_________(�����)
��ˮ �ڳ���ʯ��ˮ
��Na2CO3��Һ �ܱ��͵�NaHSO3 ��Һ
��3��װ��C��D �в�����������ͬ����ԭ��ȴ��ͬ��C�з�Ӧ�ķ���ʽ��_______________________________________����D ����������SO2 ����_______�ԣ�D�з�Ӧ�ķ���ʽ��________________________��
��4��ʵ���У�0.1molCu�뺬0.2mol�������Һ��Ӧ��ͭ�����ᶼ��ʣ�ࡣ ����֤���������ʵ�鷽����___________
A�����ټ���п�� B�����ټ����Ȼ�����Һ
C���ټ������� D���ٵ���̼��������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ϊ��A��Ԫ�أ��ĵ⻯���dz��õ��л��ϳ��Լ���SnI4���۵�114.5�棬�е�364.5�棬��ˮ�⣩��ʵ�����Թ�������Ϊԭ��ͨ����ӦSn+2I2![]() SnI4�Ʊ�SnI4��װ����ͼ���г֡�����װ����ȥ��������˵����ȷ���ǣ� ��
SnI4�Ʊ�SnI4��װ����ͼ���г֡�����װ����ȥ��������˵����ȷ���ǣ� ��
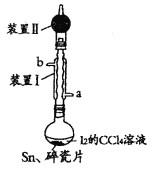
A.SnI4������CCl4
B.װ�â���bΪ����ˮ��ˮ��
C.�������Ƭ��Ŀ���Ƿ�ֹ����
D.װ�â����Ҫ���������ջӷ���I2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com