
CH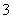 、·CH3、CH
、·CH3、CH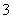 都是重要的有机物反应的中间体,CH
都是重要的有机物反应的中间体,CH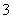 中四个原子是共平面的,则C原子是________杂化,键角应是________。
中四个原子是共平面的,则C原子是________杂化,键角应是________。
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
下列对于金属导电性随温度变化的解释,正确的是( )
A.温度增加,自由电子的动能增大,导致金属导电性增强
B.温度增加,阳离子的动能变大,阻碍电子的运动,导致金属导电性减弱
C.温度增加,自由电子的互相碰撞的次数增加,导致金属导电性减弱
D.温度增加,阳离子的动能变大,自由电子与阳离子的吸引力变小,导致金属导电性增大
查看答案和解析>>
科目:高中化学 来源: 题型:
用价电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )
A.直线形;三角锥形 B.V形;三角锥形
C.直线形;平面三角形 D.V形;平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
金属晶体、离子晶体和分子晶体采取密堆积方式的原因是( )
A.构成晶体的微粒均可视为圆球
B.金属键、离子键、分子间作用力均无饱和性和方向性
C.三种晶体的构成微粒相同
D.三种晶体的构成微粒多少及相互作用力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
具有下列电子排布的原子中最难形成离子键的是( )
A.1s22s22p2 B.1s22s22p5
C.1s22s22p63s2 D.1s22s22p63s1
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.1 mol甲醇中含有C-H键的数目为4NA
B.25 ℃,pH=13的NaOH溶液中含有OH-的数目为0.1 NA
C.标准状况下,2.24 L己烷含有分子的数目为0.1 NA
D.常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com