
”¾ĢāÄæ”æ°±ŹĒÖŲŅŖµÄµŖ·Ź£¬ŗĻ³ÉŌĄķĪŖ£ŗN2£Øg£©+3H2£Øg£© ![]() 2NH3£Øg£©”÷H=©92.4kJ/mol£®»Ų“šĻĀĮŠĪŹĢā£ŗ
2NH3£Øg£©”÷H=©92.4kJ/mol£®»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Š“³öĘ½ŗā³£ŹżKµÄ±ķ“ļŹ½ £¬ Čē¹ū½µµĶĪĀ¶Č£¬øĆ·“Ó¦KÖµE£¬»Æѧ·“Ó¦ĖŁĀŹ £¬ N2µÄ×Ŗ»ÆĀŹ£ØĢī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±£©£®
£Ø2£©ŌŚ500”ę”¢20MPaŹ±£¬½«N2”¢H2ÖĆÓŚŅ»øöČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£¬·“Ó¦¹ż³ĢÖŠø÷ÖÖĪļÖŹµÄĮæ±ä»ÆČēĶ¼ĖłŹ¾£¬»Ų“šĻĀĮŠĪŹĢā£ŗ 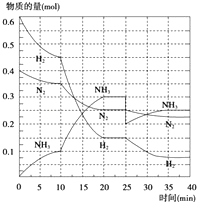
¢Ł10minÄŚŅŌNH3±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹ£ŗ £®
¢ŚŌŚ10”«20minÄŚ£ŗNH3ÅØ¶Č±ä»ÆµÄŌŅņæÉÄÜŹĒ
A£®¼ÓĮĖ“߻ƼĮ B£®ĖõŠ”ČŻĘ÷Ģå»ż
C£®½µµĶĪĀ¶Č D£®Ōö¼ÓNH3ĪļÖŹµÄĮæ
¢ŪµŚ1“ĪĘ½ŗāµÄŹ±¼äĪŖ£ŗ £¬ µŚ2“ĪĘ½ŗāµÄŹ±¼äĪŖ£ŗ £¬ µŚ1“ĪĘ½ŗā£ŗĘ½ŗā³£ŹżK1=£Ø“ųŹż¾ŻµÄ±ķ“ļŹ½£©£¬µŚ2“ĪĘ½ŗāŹ±NH3µÄĢå»ż·ÖŹż£»
¢ÜŌŚ·“Ó¦½ųŠŠÖĮ25minŹ±£¬ĒśĻß·¢Éś±ä»ÆµÄŌŅņ£ŗ £¬
“ļµŚ¶ž“ĪĘ½ŗāŹ±£¬ŠĀĘ½ŗāµÄĘ½ŗā³£ŹżK2K1 £¬ £ØĢī”°“óÓŚ”±”¢”°Š”ÓŚ”±»ņ”°µČÓŚ”±£©£®
”¾“š°ø”æ
£Ø1£©K= ![]() £»¼õŠ”£»Ōö“ó
£»¼õŠ”£»Ōö“ó
£Ø2£©0.005mol/£ØL£®min£©£»A£»20©25min£»35©40min£» £»45.5%£»ŅĘ×ß0.1molNH3£»µČÓŚ
£»45.5%£»ŅĘ×ß0.1molNH3£»µČÓŚ
”¾½āĪö”æ½ā£ŗ£Ø1£©»ÆŃ§Ę½ŗā³£ŹżŹĒĘ½ŗāŹ±ø÷Éś³ÉĪļÅØ¶ČµÄ»Æѧ¼ĘĮæŹż“ĪĆŻµÄ³Ė»ż³żŅŌø÷·“Ó¦ĪļÅØ¶ČµÄ»Æѧ¼ĘĮæŹż“ĪĆŻµÄ³Ė»żĖłµĆµÄ±ČÖµ£¬ĖłŅŌN2£Øg£©+3H2£Øg£© ![]() 2NH3£Øg£©£¬øĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½K=
2NH3£Øg£©£¬øĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½K= ![]() £»»Æѧ·“Ó¦ĖęĪĀ¶ČµÄÉżøß·“Ó¦ĖŁĀŹ¼Óæģ£¬ĖęĪĀ¶ČµÄ½µµĶ£¬·“Ó¦ĖŁĀŹ¼õĀż£¬ĖłŅŌ½µµĶĪĀ¶Č»¢ŃØ·“Ó¦ĖŁĀŹ¼õĀż£»»ÆŃ§Ę½ŗāµÄ·“Ó¦£¬½µµĶĪĀ¶ČĻņĪüČȵķ½ĻņŅĘ¶Æ£¬øĆ·“Ó¦Õż·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬½µµĶĪĀ¶Č£¬»ÆŃ§Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬ĖłŅŌµŖĘųµÄ×Ŗ»ÆĀŹŌö“ó£¬
£»»Æѧ·“Ó¦ĖęĪĀ¶ČµÄÉżøß·“Ó¦ĖŁĀŹ¼Óæģ£¬ĖęĪĀ¶ČµÄ½µµĶ£¬·“Ó¦ĖŁĀŹ¼õĀż£¬ĖłŅŌ½µµĶĪĀ¶Č»¢ŃØ·“Ó¦ĖŁĀŹ¼õĀż£»»ÆŃ§Ę½ŗāµÄ·“Ó¦£¬½µµĶĪĀ¶ČĻņĪüČȵķ½ĻņŅĘ¶Æ£¬øĆ·“Ó¦Õż·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬½µµĶĪĀ¶Č£¬»ÆŃ§Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬ĖłŅŌµŖĘųµÄ×Ŗ»ÆĀŹŌö“ó£¬
ĖłŅŌ“š°øŹĒ£ŗ ![]() £»¼õÉŁ£»Ōö“󣻣Ø2£©¢Łøł¾Ż·“Ó¦ĖŁĀŹv£ØNH3£©=
£»¼õÉŁ£»Ōö“󣻣Ø2£©¢Łøł¾Ż·“Ó¦ĖŁĀŹv£ØNH3£©= ![]() =
= ![]() =0.005mol/£ØL£®min£©£¬
=0.005mol/£ØL£®min£©£¬
ĖłŅŌ“š°øŹĒ£ŗ0.005mol/£ØL£®min£©£»
¢ŚÓÉĶ¼ĻóæÉÖŖø÷×é·ÖĪļÖŹµÄĮæ±ä»ÆŌö¼Ó£¬ĒŅ10minŹ±±ä»ÆŹĒĮ¬ŠųµÄ£¬20min“ļĘ½ŗāŹ±£¬”÷n£ØN2£©=0.025mol”Į4=0.1mol£¬
”÷n£ØH2£©=0.025mol”Į12=0.3mol£¬”÷n£ØNH3£©=0.025mol”Į8=0.2mol£¬ĪļÖŹµÄĮæ±ä»ÆÖ®±ČµČÓŚ»Æѧ¼ĘĮæŹżÖ®±Č£¬ČżÖÖĘųĢåĪļÖŹµÄĖŁĀŹŌö¼Ó±¶ŹżĻąĶ¬£¬ĖµĆ÷10minæÉÄÜøıäµÄĢõ¼žŹĒŹ¹ÓĆ“ß»Æ¼Į£¬ĖõŠ”Ģå»żĻąµ±ÓŚŌö“óŃ¹Ē棬ӦøĆ·“Ó¦ĪļµÄĖŁĀŹŌö¼Ó±¶Źż“󣬽µµĶĪĀ¶Č£¬Ó¦øĆ·“Ó¦ĖŁĀŹ¼õŠ”£¬Ōö¼ÓNH3ĪļÖŹµÄĮ棬Äę·“Ó¦ĖŁĀŹŌö¼ÓµÄ±¶Źż“󣬹ŹÖ»ÓŠŹ¹ÓĆ“ß»Æ¼Į·ūŗĻ£¬
¹ŹŃ”A£»
¢ŪÓÉĶ¼ĻóæÉŅŌ擳ö£¬µ±·“Ó¦½ųŠŠµ½Ź±20©25min£¬ø÷ĪļÖŹµÄĮæ²»±ä£¬ĖµĆ÷·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬»ÆŃ§Ę½ŗā³£ŹżµČÓŚÉś³ÉĪļÅضČĆŻÖ®»żÓė·“Ó¦ĪļÅضČĆŻÖ®»żµÄ±Č£¬ÓÉĶ¼ĻóæÉÖŖ£¬20min“ļĘ½ŗāŹ±£¬n£ØN2£©=0.025mol”Į10=0.25mol£¬n£ØH2£©=0.025mol”Į6=0.15mol£¬n£ØNH3£©=0.025mol”Į12=0.3mol£¬ĖłŅŌĖłŅŌĘäĘ½ŗā³£ŹżK= ![]() =
=  =426.7£»µŚ2“ĪĘ½ŗāŹ±NH3µÄĢå»ż·ÖŹż=
=426.7£»µŚ2“ĪĘ½ŗāŹ±NH3µÄĢå»ż·ÖŹż= ![]() ”Į100%=45.5%£¬
”Į100%=45.5%£¬
ĖłŅŌ“š°øŹĒ£ŗ20©25min£¬35©40min£»  £»45.5%£»
£»45.5%£»
¢ÜµŚ25·ÖÖÓ£¬NH3µÄĪļÖŹµÄĮæĶ»Č»¼õÉŁ£¬¶ųH2”¢N2µÄĪļÖŹµÄĮæ²»±ä£¬ĖµĆ÷Ó¦ŹĒ·ÖĄė³öNH3£»ÓÉĶ¼ĻóæÉŅŌ擳ö£¬µ±·“Ó¦½ųŠŠµ½Ź±35©40min£¬ø÷ĪļÖŹµÄĮæ²»±ä£¬ĖµĆ÷·“Ó¦“ļµ½µŚ¶ž“ĪĘ½ŗāדĢ¬£¬Ę½ŗā³£ŹżÖ»ŹÜĪĀ¶ČÓ°Ļģ£¬ĪĀ¶Č²»±ä£¬Ę½ŗā³£Źż²»±ä£¬ĖłŅŌ³éČ„0.1mol°±£¬“ĖŹ±Ę½ŗā³£ŹżK½«²»±ä£»
ĖłŅŌ“š°øŹĒ£ŗ·ÖĄė³ö0.1molNH3£»µČÓŚ£»
”¾æ¼µć¾«Īö”æ±¾ĢāÖ÷ŅŖæ¼²éĮĖ·“Ó¦ĖŁĀŹµÄ¶ØĮæ±ķŹ¾·½·ØŗĶ»ÆŃ§Ę½ŗā³£ŹżµÄŗ¬ŅåµÄĻą¹ŲÖŖŹ¶µć£¬ŠčŅŖÕĘĪÕ·“Ó¦ĖŁĀŹµÄµ„Ī»£ŗmol/(L”¤min)»ņmol/(L”¤s) v=”÷c-”÷t£»ÖøŌŚŅ»¶ØĢõ¼žĻĀµÄæÉÄę·“Ó¦Ąļ£¬Õż·“Ó¦ŗĶÄę·“Ó¦µÄĖŁĀŹĻąµČ£¬·“Ó¦»ģŗĻĪļÖŠø÷×é·ÖµÄÅØ¶Č²»±äµÄדĢ¬²ÅÄÜÕżČ·½ā“š“ĖĢā£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĶ¬Ī»ĖŲŹ¾×Ł·ØæÉÓĆÓŚ·“Ó¦»śĄķµÄŃŠ¾æ£¬ĻĀĮŠ·“Ó¦»ņ×Ŗ»ÆÖŠĶ¬Ī»ĖŲŹ¾×Ł±ķŹ¾ÕżČ·µÄŹĒ£Ø £©
A.2Na218O2+2H2OØT4Nal8OH+O2”ü
B.NH4Cl+2H2OØTNH32H2O+HCl
C.2KMnO4+5H218O2+3H2SO4ØTK2SO4+2MnSO4+518O2”ü+8H2O
D.K37ClO3+6HClØTK37Cl+3Cl2”ü+3H2O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÉś»īÖŠÄŃĆā»įÓöµ½Ņ»Š©Ķ»·¢ŹĀ¼ž£¬ĪŅĆĒŅŖÉĘÓŚĄūÓĆѧ¹żµÄÖŖŹ¶£¬²ÉČ”æĘѧ”¢ÓŠŠ§µÄ·½·Ø±£»¤×Ō¼ŗ”£Čē¹ū·¢ÉśĮĖĀČĘųŠ¹Ā©£¬ŅŌĻĀ×Ō¾Č·½·ØµĆµ±µÄŹĒ
A. Ö»ŅŖŌŚŹŅÄŚ·ÅŅ»ÅčĖ®B. ĻņµŲŹĘµĶµÄµŲ·½³·ĄėC. ¹Ū²ģ·ēĻņ£¬Ė³·ē³·ĄėD. ÓĆŹŖĆ«½ķ»ņÕŗÓŠŹÆ¼īĖ®µÄĆ«½ķĪę×”æŚ±Ē³·Ąė
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚÓŠ»śĪļµÄĖµ·Ø“ķĪóµÄŹĒ
A. ±½ŹĒŅ»ÖÖĪŽÉ«ĪŽĪ¶ŅŗĢ壬ÄŃČÜÓŚĖ®£¬³£ÓĆ×÷ÓŠ»śČܼĮ
B. ŅŅĻ©æÉ×÷ĪŖÖ²ĪļÉś³¤µ÷½Ś¼Į
C. Ģå»ż·ÖŹżĪŖ75%µÄŅŅ“¼ČÜŅŗæÉÓĆ×÷Ņ½ÓĆĻū¶¾¼Į
D. “×ĖįæÉŅŌÓĆÓŚ³żČ„²čŗųÖŠµÄĖ®¹ø
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŗĻ½šŅŃ³ÉĪŖ·É»śÖĘŌģ”¢»Æ¹¤Éś²śµČŠŠŅµµÄÖŲŅŖ²ÄĮĻ£®ŃŠ¾æŠŌѧĻ°Š”×éµÄĶ¬Ń§£¬ĪŖ²ā¶Øijŗ¬Ć¾3%”«5%µÄĀĮĆ¾ŗĻ½š£Ø²»ŗ¬ĘäĖüŌŖĖŲ£©ÖŠĆ¾µÄÖŹĮæ·ÖŹż£¬Éč¼ĘĻĀĮŠĮ½ÖÖ²»Ķ¬ŹµŃé·½°ø½ųŠŠĢ½¾æ£®ĢīŠ“ĻĀĮŠæÕ°×£®
£Ø1£©”¾ŹµŃé·½°øŅ»”潫ĀĮĆ¾ŗĻ½šÓė×ćĮæNaOHČÜŅŗ·“Ó¦£¬²ā¶ØŹ£Óą¹ĢĢåÖŹĮ森ŹµŃéÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ ”¾ŹµŃé²½Öč”æ
³ĘČ”5.4gĀĮĆ¾ŗĻ½š·Ūĩѳʷ£¬ČÜÓŚVmL 2.0mol/LNaOHČÜŅŗÖŠ£¬³ä·Ö·“Ó¦£®ŌņNaOHČÜŅŗµÄĢå»żV”Ż £®
£Ø2£©¹żĀĖ”¢Ļ“µÓ”¢øÉŌļ”¢³ĘĮæ¹ĢĢ壮øĆ²½ÖčÖŠČōĪ“Ļ“µÓ¹ĢĢ壬²āµĆĆ¾µÄÖŹĮæ·ÖŹż½«£ØĢī”°Ę«øß”±”¢”°Ę«µĶ”±»ņ”°ĪŽÓ°Ļģ”±£©£®
£Ø3£©”¾ŹµŃé·½°ø¶ž”æ ½«ĀĮĆ¾ŗĻ½šÓė×ćĮæĻ”ĮņĖįČÜŅŗ·“Ó¦£¬²ā¶ØÉś³ÉĘųĢåŌŚĶس£×“æö£ØŌ¼20”ę£¬1.01105Pa£©µÄĢå»ż£®
”¾ĪŹĢāĢÖĀŪ”æ
Ķ¬Ń§ĆĒÄāŃ”ÓĆĶ¼1ŹµŃé×°ÖĆĶź³ÉŹµŃé£ŗ
¢ŁÄćČĻĪŖ×ī¼ņŅ×µÄ×°ÖĆĘäĮ¬½ÓĖ³ŠņŹĒ£ŗA½Ó½Ó½Ó£ØĢī½ÓæŚ×ÖÄø£¬æɲ»ĢīĀś£®£©
¢ŚŹµŃéæŖŹ¼Ź±£¬ĻČ“ņæŖ·ÖŅŗĀ©¶·ÉĻæŚµÄ²£Į§Čū£¬ŌŁĒįĒį“ņæŖĘä»īČū£¬Ņ»»į¶łŗóĻ”ĮņĖįŅ²²»ÄÜĖ³ĄūµĪČė׶ŠĪĘ森ĒėÄć°ļÖś·ÖĪöŌŅņ£® £®
¢ŪŹµŃé½įŹųŹ±£¬ŌŚ¶ĮČ”²āĮæŹµŃéÖŠÉś³ÉĒāĘųµÄĢå»żŹ±£¬ÄćČĻĪŖŗĻĄķµÄŹĒ £®
A£®“żŹµŃé×°ÖĆĄäČ“ŗóŌŁ¶ĮŹż
B£®ÉĻĻĀŅʶÆĮæĶ²F£¬Ź¹ĘäÖŠŅŗĆęÓė¹ćæŚĘæÖŠŅŗĆęĻąĘ½
C£®ÉĻĻĀŅʶÆĮæĶ²G£¬Ź¹ĘäÖŠŅŗĆęÓė¹ćæŚĘæÖŠŅŗĆęĻąĘ½
D£®ŹÓĻßÓė°¼ŅŗĆęµÄ×īµĶµćĖ®Ę½£¬¶ĮČ”ĮæĶ²ÖŠĖ®µÄĢå»ż
£Ø4£©×ŠĻø·ÖĪöŹµŃé×°ÖĆŗó£¬Ķ¬Ń§ĆĒ¾ĢÖĀŪČĻĪŖŅŌĻĀĮ½µć»įŅżĘš½Ļ“óĪó²ī£ŗĻ”ĮņĖįµĪČė׶ŠĪĘæÖŠ£¬¼“Ź¹²»Éś³ÉĒāĘų£¬Ņ²»į½«ĘæÄŚæÕĘųÅųö£¬Ź¹Ėł²āĒāĘųĢå»żĘ«“ó£»ŹµŃé½įŹųŹ±£¬Į¬½Ó¹ćæŚĘæŗĶĮæĶ²µÄµ¼¹ÜÖŠÓŠÉŁĮæĖ®“ęŌŚ£¬Ź¹Ėł²āĒāĘųĢå»żĘ«Š”£®ÓŚŹĒĖūĆĒÉč¼ĘĮĖĶ¼2ĖłŹ¾µÄŹµŃé×°ÖĆ£® ¢Ł×°ÖĆÖŠµ¼¹ÜaµÄ×÷ÓĆŹĒ £®
¢ŚŹµŃéĒ°ŗó¼īŹ½µĪ¶Ø¹ÜÖŠŅŗĆę¶ĮŹż·Ö±šĪŖV1mL”¢V2mL£®Ōņ²śÉśĒāĘųµÄĢå»żĪŖmL£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŠšŹöÖŠ,ÕżČ·µÄŹĒ””(””””)
A.ŅŅĶéÓėĀČĘųŌŚ¹āÕÕĢõ¼žĻĀÉś³ÉµÄĀČŅŅĶéÖŠ£¬¼ČÓŠ1£¬1-¶žĀČŅŅĶ飬ÓÖÓŠ1£¬2-¶žĀČŅŅĶé
B.ŅŅĻ©·Ö×ÓÖŠĖłÓŠŌ×Ó¹²Ę½Ćę£¬·Ö×ÓÖŠĖłŗ¬»Æѧ¼üĪŖ·Ē¼«ŠŌ¹²¼Ū¼ü
C.ŅŅĻ©ÓėHBrŌŚŅ»¶ØĢõ¼žĻĀ·¢ÉśČ”“ś·“Ó¦æÉÉś³ÉäåŅŅĶé
D.±½ÓėäåĖ®ŌŚFeBr3×÷“߻ƼĮµÄĢõ¼žĻĀÉś³Éäå±½
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄ³Ń§ÉśÓūÓĆŅŃÖŖĪļÖŹµÄĮæÅØ¶ČµÄŃĪĖįĄ“²ā¶ØĪ“ÖŖĪļÖŹµÄĮæÅØ¶ČµÄNaOHČÜŅŗŹ±£¬Ń”Ōń¼×»ł³Č×÷ÖøŹ¾¼Į£®ĒėĢīæÕ£®
£Ø1£©ČēĶ¼1ŹĒ³£¼ūŅĒĘ÷µÄ²æ·Ö½į¹¹£® 
¢ŁŠ“³öŅĒĘ÷Ćū³ĘBC
¢ŚŹ¹ÓĆĒ°Šč¼ģ²éŹĒ·ńĀ©Ė®µÄŅĒĘ÷ÓŠ £®
£Ø2£©ÓƱź×¼µÄŃĪĖįµĪ¶Ø“ż²āµÄNaOHČÜŅŗŹ±£¬×óŹÖĪÕĖįŹ½µĪ¶Ø¹ÜµÄ»īČū£¬ÓŅŹÖŅ”¶Æ׶ŠĪĘ棬ŃŪ¾¦×¢ŹÓ £® µĪ¶ØÖÕµćŹ±£¬×¶ŠĪĘæÖŠŃÕÉ«±ä»ÆĪŖ £¬ ĒŅ°ė·ÖÖÓÄŚŃÕÉ«²»ø“Ō£®
£Ø3£©ĻĀĮŠ²Ł×÷ÖŠæÉÄÜŹ¹Ėł²āNaOHČÜŅŗµÄÅØ¶ČŹżÖµĘ«µĶµÄŹĒ
A.ĖįŹ½µĪ¶Ø¹ÜĪ“ÓƱź×¼ŃĪĖįČóĻ“¾ĶÖ±½Ó×¢Čė±ź×¼ŃĪĖį
B.µĪ¶ØĒ°Ź¢·ÅNaOHČÜŅŗµÄ׶ŠĪĘæÓĆÕōĮóĖ®Ļ“¾»ŗóƻӊøÉŌļ
C.ĖįŹ½µĪ¶Ø¹ÜŌŚµĪ¶ØĒ°ÓŠĘųÅŻ£¬µĪ¶ØŗóĘųÅŻĻūŹ§
D.¶ĮČ”ŃĪĖįĢå»żŹ±£¬æŖŹ¼ŃöŹÓ¶ĮŹż£¬µĪ¶Ø½įŹųŹ±ø©ŹÓ¶ĮŹż
£Ø4£©ČōµĪ¶ØæŖŹ¼ŗĶ½įŹųŹ±£¬ĖįŹ½µĪ¶Ø¹ÜÖŠµÄŅŗĆęČēĶ¼2ĖłŹ¾£¬ĖłÓĆŃĪĖįČÜŅŗµÄĢå»żĪŖmL£®
£Ø5£©Ä³Ń§Éśøł¾Ż3“ĪŹµŃé·Ö±š¼ĒĀ¼ÓŠ¹ŲŹż¾ŻČē±ķ£ŗ
µĪ¶Ø | “ż²āNaOHČÜŅŗµÄĢå»ż/mL | 0.100 0mol/LŃĪĖįµÄĢå»ż/mL | ||
µĪ¶ØĒ°æĢ¶Č | µĪ¶ØŗóæĢ¶Č | ČÜŅŗĢå»ż/mL | ||
µŚŅ»“Ī | 25.00 | 0.00 | 25.11 | 25.11 |
µŚ¶ž“Ī | 25.00 | 0.56 | 30.56 | 30.00 |
µŚČż“Ī | 25.00 | 0.22 | 25.11 | 24.89 |
ŅĄ¾Ż±ķŹż¾ŻĮŠŹ½¼ĘĖćøĆNaOHČÜŅŗµÄĪļÖŹµÄĮæÅØ¶Č £® £Ø±£ĮōĮ½Ī»ÓŠŠ§Źż×Ö£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ°±ŹĒÖŲŅŖµÄµŖ·Ź£¬ŗĻ³ÉŌĄķĪŖ£ŗN2£Øg£©+3H2£Øg£© ![]() 2NH3£Øg£©”÷H=©92.4kJ/mol£®»Ų“šĻĀĮŠĪŹĢā£ŗ
2NH3£Øg£©”÷H=©92.4kJ/mol£®»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Š“³öĘ½ŗā³£ŹżKµÄ±ķ“ļŹ½ £¬ Čē¹ū½µµĶĪĀ¶Č£¬øĆ·“Ó¦KÖµE£¬»Æѧ·“Ó¦ĖŁĀŹ £¬ N2µÄ×Ŗ»ÆĀŹ£ØĢī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±£©£®
£Ø2£©ŌŚ500”ę”¢20MPaŹ±£¬½«N2”¢H2ÖĆÓŚŅ»øöČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£¬·“Ó¦¹ż³ĢÖŠø÷ÖÖĪļÖŹµÄĮæ±ä»ÆČēĶ¼ĖłŹ¾£¬»Ų“šĻĀĮŠĪŹĢā£ŗ 
¢Ł10minÄŚŅŌNH3±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹ£ŗ £®
¢ŚŌŚ10”«20minÄŚ£ŗNH3ÅØ¶Č±ä»ÆµÄŌŅņæÉÄÜŹĒ
A£®¼ÓĮĖ“߻ƼĮ B£®ĖõŠ”ČŻĘ÷Ģå»ż
C£®½µµĶĪĀ¶Č D£®Ōö¼ÓNH3ĪļÖŹµÄĮæ
¢ŪµŚ1“ĪĘ½ŗāµÄŹ±¼äĪŖ£ŗ £¬ µŚ2“ĪĘ½ŗāµÄŹ±¼äĪŖ£ŗ £¬ µŚ1“ĪĘ½ŗā£ŗĘ½ŗā³£ŹżK1=£Ø“ųŹż¾ŻµÄ±ķ“ļŹ½£©£¬µŚ2“ĪĘ½ŗāŹ±NH3µÄĢå»ż·ÖŹż£»
¢ÜŌŚ·“Ó¦½ųŠŠÖĮ25minŹ±£¬ĒśĻß·¢Éś±ä»ÆµÄŌŅņ£ŗ £¬
“ļµŚ¶ž“ĪĘ½ŗāŹ±£¬ŠĀĘ½ŗāµÄĘ½ŗā³£ŹżK2K1 £¬ £ØĢī”°“óÓŚ”±”¢”°Š”ÓŚ”±»ņ”°µČÓŚ”±£©£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖÓŠČČ»Æѧ·½³ĢŹ½£ŗSO2£Øg£©+ ![]() O2£Øg£©ØTSO3£Øg£©”÷H=©98.32kJ/molĻÖÓŠ4molSO2²Ī¼Ó·“Ó¦£¬µ±·Å³ö314.3kJČČĮæŹ±£¬SO2µÄ×Ŗ»ÆĀŹ×ī½Ó½üÓŚ£Ø £©
O2£Øg£©ØTSO3£Øg£©”÷H=©98.32kJ/molĻÖÓŠ4molSO2²Ī¼Ó·“Ó¦£¬µ±·Å³ö314.3kJČČĮæŹ±£¬SO2µÄ×Ŗ»ÆĀŹ×ī½Ó½üÓŚ£Ø £©
A.40%
B.50%
C.80%
D.90%
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com