
| A. | $\frac{5000(2b-a)}{V}$mol/L | B. | $\frac{5(2b-a)}{V}$mol/L | C. | $\frac{(2b-a)}{V}$mol/L | D. | $\frac{1000(2b-a)}{V}$mol/L |
分析 5等份溶液中一份加BaCl2的溶液发生Ba2++SO42-═BaSO4↓,由方程式可知n(SO42-)=n(Ba2+),另一份加氢氧化钠溶液时发生Mg2++2OH-═Mg(OH)2↓,由方程式可知每份溶液中n(Mg2+)=$\frac{1}{2}$n(OH-),
再利用电荷守恒可知每份中2n(Mg2+)+n(K+)=2n(SO42-),据此计算每份中n(K+),根据c=$\frac{n}{V}$计算钾离子浓度.
解答 解:混合溶液分成5等份,每份溶液浓度与原溶液浓度相同,
一份加BaCl2的溶液发生Ba2++SO42-═BaSO4↓,由方程式可知n(SO42-)=n(Ba2+)=n(BaCl2)=bmol,
另一份加氢氧化钠溶液时发生Mg2++2OH-═Mg(OH)2↓,由方程式可知每份溶液中n(Mg2+)=$\frac{1}{2}$n(OH-)=$\frac{1}{2}$amol,
由电荷守恒可知每份中2n(Mg2+)+n(K+)=2n(SO42-),故每份中溶液n(K+)=2b-2×$\frac{1}{2}$amol=(2b-a)mol,
则原混合溶液中钾离子的浓度为:$\frac{(2b-a)mol}{\frac{1}{5}V×1{0}^{-3}L}$=$\frac{5000(2b-a)}{V}$mol/L,
故选A.
点评 本题考查混合物反应的计算,为高频考点,题目难度中等,根据电荷守恒计算钾离子的物质的量是关键,试题侧重分析与计算能力的考查.


科目:高中化学 来源: 题型:解答题
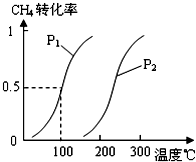 甲醇被称为2l世纪的新型燃料,工业上通过下列反应①②,用CH4和H2O为原料来制备甲醇.
甲醇被称为2l世纪的新型燃料,工业上通过下列反应①②,用CH4和H2O为原料来制备甲醇.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 实验方案 | 现象 | 结论 |
| A | 加入盐酸 | 产生无色气体 | 含铝、铁、镁三种元素 |
| B | 加入NaOH溶液 | 产生无色气体 | 含有铝元素 |
| C | 加盐酸溶解后,再加入少量NaOH溶液 | 产生白色沉淀 | 含有镁元素 |
| D | 加盐酸溶解后,再滴加KSCN溶液 | 溶液呈血红色 | 含有铁元素 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 粒子 | K+ | A - | X | Y | Z |
| 浓度(mol/L) | 0.50 | 0.49 | c(X)>c(Y)>c(Z) | ||
| A. | 元素A最高价氧化物对应水化物为HAO4 | |
| B. | 表格中X表示HA,Y表示H+ | |
| C. | 所得溶液中c(X)+c(A-)=c(K+) | |
| D. | 等体积等浓度的HA和盐酸分别加水稀释10倍后,pH (HA)>pH(HCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
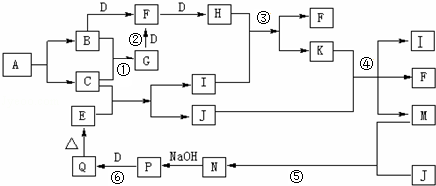
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2 (g)+O2(g)═2H2O(g )△H=-483.6kJ/mol,则H2的燃烧热为△H=-241.8kJ/mol | |
| B. | 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4kJ/mol | |
| C. | 反应NH3(g)+HCl(g)═NH4Cl (s)△H<0,该反应在任何温度下都可自发进行 | |
| D. | 已知C(s)+O2(g)═CO2(g)△H1;C(s)+$\frac{1}{2}$O2(g)═CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸可以通过SiO2和水化合反应直接制得 | |
| B. | 可用反应Na2SiO3+2HCl═2NaCl+H2SiO3↓制取硅酸 | |
| C. | 因为硅酸难溶于水,所以它不能与NaOH溶液反应 | |
| D. | 干燥剂“硅胶”的主要成分是硅酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验一:向饱和AlCl3溶液中滴加氨水以制备Al(OH)3胶体 | |
| B. | 实验二:用饱和NaHCO3溶液除去混在Cl2中的HCl气体 | |
| C. | 实验三:用Na2O2与水反应制氧气 | |
| D. | 实验四:用Cl2除去Fe2(SO4)3溶液中的少量FeSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com