
【题目】化学——选修2:化学与技术]双氧水是一种重要的氧化剂、漂白剂和消毒剂。生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:
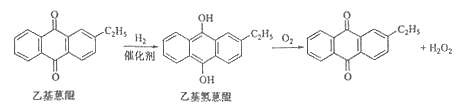
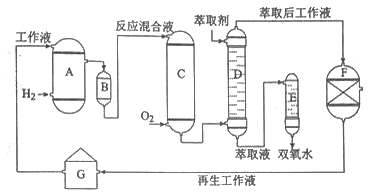
A.氢化釜 |
B.过滤器 |
C.氧化塔 |
D.萃取塔 |
E.净化塔
F.工作液再生装置
G.工作液配制装置 生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定的温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水。回答下列问题:
(1)蒽醌法制备双氧水理论上消耗的原料是 ,循环使用的原料是 ,配制工作液时采用有机溶剂而不采用水的原因是 。
(2)氢化釜A中反应的化学方程式为 ,进入氧化塔C的反应混合液中的主要溶质为 。
(3)萃取塔D中的萃取剂是,选择其作萃取剂的原因是 。
(4)工作液再生装置F中要除净残留的H2O2,原因是 。
(5)双氧水浓度可在酸性条件下用 KMnO4溶液测定,该反应的离子方程式为___________一种双氧水的质量分数为27.5%,(密度为1.10g·cm3),其浓度为 mol/L。
【答案】(1)氢气和氧气,乙基蒽醌,乙基蒽醌不溶于水,易溶于有机溶剂;
(2)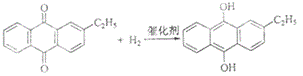 ,乙基氢蒽醌;
,乙基氢蒽醌;
(3)水,H2O2溶于水被水萃取,乙基蒽醌不溶于水;
(4)H2O2分解放出氧气,与氢气混合,易发生爆炸;
(5)5H2O2+6H++2MnO4-=2Mn2++8H2O+5O2↑,8.9mol·L-1。
【解析】试题分析:(1)根据反应原理,两式相加,乙基蒽醌作催化剂,使H2+O2=H2O2,因此理论上消耗的原料是氢气和氧气,循环使用原料是乙基蒽醌,根据题意,乙基蒽醌不溶于水,易溶于有机溶剂;(2)氢化釜A,发生的反应是乙基蒽醌和氢气的反应,因此反应方程式为: ,氧化塔C中发生反应是乙基氢蒽醌和氧气的反应,因此混合液中的主要溶质为乙基氢蒽醌;(3)过氧化氢易溶于水,乙基蒽醌不溶于水,因此用水进行萃取;(4)过氧化氢不稳定,易分解成氧气,氢气与氧气混合易发生爆炸;(5)H2O2既有氧化性又有还原性,高锰酸钾溶液的氧化性把H2O2氧化成氧气,根据化合价配平法进行配平,因此反应方程式为:H2O2+6H++2MnO4-=2Mn2++8H2O+5O2↑,根据c=1000ρw%/M,代入数值,得出c=8.9mol·L-1。
,氧化塔C中发生反应是乙基氢蒽醌和氧气的反应,因此混合液中的主要溶质为乙基氢蒽醌;(3)过氧化氢易溶于水,乙基蒽醌不溶于水,因此用水进行萃取;(4)过氧化氢不稳定,易分解成氧气,氢气与氧气混合易发生爆炸;(5)H2O2既有氧化性又有还原性,高锰酸钾溶液的氧化性把H2O2氧化成氧气,根据化合价配平法进行配平,因此反应方程式为:H2O2+6H++2MnO4-=2Mn2++8H2O+5O2↑,根据c=1000ρw%/M,代入数值,得出c=8.9mol·L-1。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列图像中的曲线(纵坐标为沉淀或气体的量,横坐标为加入物质的量),其中错误的是
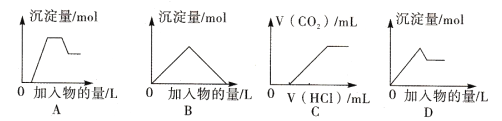
A. 图A表示向含H+、Mg2+、Al3+、NH4+的溶液中滴加NaOH溶液产生沉淀量的关系曲线
B. 图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线
C. 图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线
D. 图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀量的关系曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出该反应的离子方程式:______________。
(2)下列三种情况下,离子方程式与(1)相同的是(填序号)。
A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量
(3)若Ba(OH)2溶液中缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用如下图1中的_________(填序号)曲线表示。
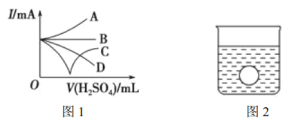
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如上图2所示。向该烧杯中缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将__________。(填“上升”、“下降”或“保持不动”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物的种类很多,我们可以按照“金属单质、金属氧化物、金属氢氧化物、盐”的类别进行研究。以下是元素周期表中前18号某种金属元素对应的单质及其化合物之间的转化关系(“→”所指的转化都是一步完成)。

(1)A与水反应的离子方程式:_______________。
(2)若B为呼吸面具中的供氧剂,其供氧时每生成1molO2,反应过程中转移的电子数为____________。
(3)200℃时,11.6gCO2和H2O的混合物气体与足量的B反应,反应后固体增加了3.6g,则原混合物的平均相对分子质量为__________。
(4)写出一种“C→D”转化的离子方程式:_____________。
(5)某同学将一小块A单质露置于空气中,观察到下列现象:
![]() ,则下列说法正确的是
,则下列说法正确的是
A.①发生了氧化还原反应
B.①变灰暗色是因为生成了过氧化钠
C.③是碳酸钠吸收空气中的水蒸气形成了溶液
D.④只发生物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水垢成分之一的氢氧化镁溶于稀盐酸的离子方程式书写正确的是
A. Mg(OH)2+H+ = Mg2++H2O B. Mg(OH)2+HCl=Mg2++H2O+Cl-
C. Mg(OH)2+2H+ = Mg2++2H2O D. OH-+ H+ = H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应Zn+2HCl=ZnCl2+H2↑,下列说法正确的是
A. HCl是还原剂 B. HCl是氧化剂
C. HCl既是氧化剂又是还原剂 D. HCl既不是氧化剂也不是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语完全正确的一组是:( )
A.次氯酸电子式:![]() ,过氧化钠的电子式为:
,过氧化钠的电子式为:![]() ,羟基电子式为
,羟基电子式为![]()
B.KHSO4熔融电离:KHSO4=K++H++SO42-,KHCO3溶解于水,其电离:KHCO3=K++H++CO32-
C.高聚物化学式:聚异戊二烯 ,PVC
,PVC![]() ,PE
,PE![]()
D.下列分子式代表的有机物均有可能与 NaHCO3 反应放出 CO2:C5H12O2、C2H4O2、 C7H8O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚锡(SnSO4)是一种重要的硫酸盐,主要用于电镀工业的镀锡、铝合金表面的氧化着色、印染工业的媒染剂、双氧水去除剂等。某研究小组设计SnSO4制备路线如下:
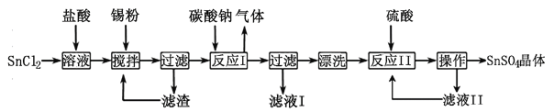
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成难溶物Sn(OH)Cl(碱式氯化亚锡)。
III.Sn(OH)2的性质与Al(OH)3性质相似。请回答下列问题:
(1)SnCl2粉末需加浓盐酸进行溶解,这样操作的原因是。
(2)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子方程式是。
(3)将反应I滤液中的溶质提取出来的操作是,滤液I溶质的成分是。
(4)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是。
(5)称取SnSO4·xH2O晶体50.2g,在隔绝空气的情况下小火加热至结晶水全部失去,冷却称量固体质量为43g,则该晶体的化学式为。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com