
| A. | 纯水的导电性很差,所以水不是电解质 | |
| B. | SO2水溶液的导电性很好,所以SO2是电解质 | |
| C. | 熔融状态时铜的导电性很好,所以铜是电解质 | |
| D. | 硝酸钾在水中和熔融状态时都能导电,所以硝酸钾是电解质 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 10mol和10% | B. | 20mol和40% | C. | 20mol和20% | D. | 30mol和80% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
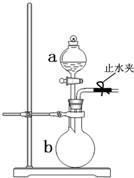 如图所示装置是实验室常用的气体制取装置.据图回答下列问题:
如图所示装置是实验室常用的气体制取装置.据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Ca2+)>c(Cl-)>c ( NO3-) | B. | c(Ca2+)>c ( NO3-)>c (Cl-) | ||
| C. | c(NO3-)>c ( Ca2+ )>c ( Cl-) | D. | c ( Cl-)>c(Ca2+)>c(NO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若x>z则a>b | B. | x=y>z 则a<b | C. | x=z<y则a=b | D. | x<z=y则a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能(KJ/mol) | 356 | 413 | 336 | 226 | 318 | 452 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com