
 实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验;请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验;请完成下列填空:| 滴定次数 | 待测盐酸的体积(mL) | 标准NaOH溶液体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 20.00 | 0.40 | 20.50 |
| 第二次 | 20.00 | 4.10 | 24.00 |
| 第三次 | 20.00 | 1.00 | 24.00 |
分析 (1)①配制100mL0.10mol•L-1NaOH标准溶液需要的玻璃仪器有烧杯、量筒、玻璃棒、100mL容量瓶、胶头滴管等;
②根据m=nM计算质量;称取氢氧化钠固体所需仪器有天平(带砝码、镊子)、药匙、烧杯;
(2)装配制的标准NaOH溶液用碱式滴定管;
(3)①滴加2~3滴酚酞溶液作指示剂,最后一滴NaOH溶液加入时,溶液颜色恰好由无色变为(浅)红色,且半分钟内颜色不再改变,说明达到终点;
②根据c(酸)×V(酸)=c(碱)×V(碱)计算;
③给润洗后的滴定管中注入溶液时应借助于烧杯;
④碱式滴定管的气泡通常在橡皮管内,只要将滴定玻璃头朝上,并挤橡皮管中的玻璃珠就可以将气泡冲排出;
⑤根据c(待)=$\frac{c(标)×V(标)}{V(待)}$分析误差.
解答 解:(1)①配制100mL0.10mol•L-1NaOH标准溶液需要的玻璃仪器有烧杯、量筒、玻璃棒、100mL容量瓶、胶头滴管等,
故答案为;100mL容量瓶、胶头滴管;
②氢氧化钠的质量为m=nM=0.10L×0.10moL/L×40g/mol=0.4g;称取氢氧化钠固体所需仪器有天平(带砝码、镊子)、药匙、烧杯,
故答案为:0.4;烧杯;
(2)装配制的标准NaOH溶液用碱式滴定管,
故答案为:碱式滴定管;
(3)①滴加2~3滴酚酞溶液作指示剂,最后一滴NaOH溶液加入时,溶液颜色恰好由无色变为(浅)红色,且半分钟内颜色不再改变,说明达到终点,
故答案为:最后一滴NaOH溶液加入时,溶液颜色恰好由无色变为(浅)红色,且半分钟内颜色不再改变,说明达到终点;
②根据c(酸)×V(酸)=c(碱)×V(碱),3次实验所用V(NaOH)分别是20.10mL、19.90mL、23.00mL,第3次实验数据误差较大,舍去,则前2次V(NaOH)的平均值为20.00mL,则该盐酸的浓度为$\frac{20.00mL×0.10mol/L}{20.00mL}$=0.10mol/L,
故答案为:0.10;
③给润洗后的滴定管中注入溶液时应借助于烧杯,
故答案为:C;
④碱式滴定管的气泡通常在橡皮管内,只要将滴定玻璃头朝上,并挤橡皮管中的玻璃珠就可以将气泡冲排出,
故答案为:丙;
⑤A.酸式滴定管水洗后未用待测稀盐酸溶液润洗,会导致盐酸浓度偏小,需要NaOH体积偏小,测定值偏小,故A正确;
B.锥形瓶水洗后后未干燥,对实验无影响,故B错误;
C.称量NaOH固体中混有Na2CO3固体,等质量的碳酸钠和氢氧化钠,碳酸钠消耗的盐酸偏低,在滴定时消耗的标准液体积偏大,测定结果偏高,故C错误;
D.滴定到达终点时,俯视读出滴定管读数,会导致NaOH体积偏小,测定溶液浓度偏小,故D正确;
E.碱式滴定管尖嘴部分有气泡,滴定后消失,会导致测定NaOH体积偏大,测定值偏大,故E错误;
故答案为:AD.
点评 本题考查中和滴定操作,题目难度中等,注意把握实验基本方法,能会分析导致误差的不当操作,注意把握实验操作要点和注意事项.


科目:高中化学 来源: 题型:解答题
 氨和硝酸都是重要的化学品.
氨和硝酸都是重要的化学品.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯乙烷水解制乙醇;丙烯与氯化氢反应 | |
| B. | 乙酸和乙醇制乙酸乙酯;苯与液溴的反应 | |
| C. | 2-氯丙烷制丙烯;由乙炔与溴的反应 | |
| D. | 氯乙烯制聚氯乙烯;由苯乙酸甲酯的水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 正极反应式:Ag+Cl--e-=AgCl | |
| B. | 每生成1mol Na2Mn5O10转移2mol电子 | |
| C. | Na+不断向“水”电池的负极移动 | |
| D. | 若用阳离子交换膜,当电路中转移0.2mole-,负极区将减少0.4mol离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )| A. | 电源B极是正极 | |
| B. | 装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷 | |
| C. | 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| D. | (甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
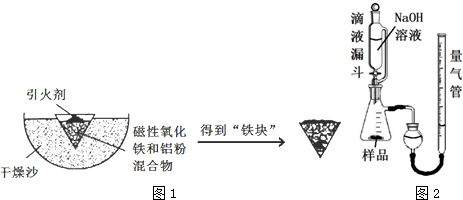
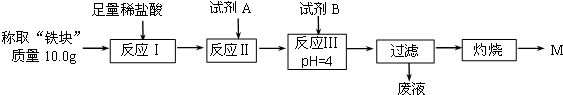
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 侯氏制碱法的基本原理:Na++NH3+H2O+CO2=NaHCO3↓+NH4+ | |
| B. | 向KAl(SO4)2溶液中加入Ba(OH)2溶液至中性:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 硫酸亚铁溶液中滴加酸化的双氧水:2Fe2++2H++H2O2=2Fe3++2H2O | |
| D. | 向漂白粉溶液中通入少量的SO2气体:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com