
分析 根据n=$\frac{m}{M}$计算氢氧化钠的物质的量,再根据c=$\frac{n}{V}$计算溶液物质的量浓度,溶液是均匀的,取出10mL溶液的浓度与原溶液浓度相等,根据稀释前后溶质的物质的量不变计算稀释后溶液物质的量浓度.
解答 解:4g NaOH的物质的量为:$\frac{4g}{40g/mol}$=0.1mol,溶于水配成250mL溶液,此溶液中NaOH的物质的量浓度为:$\frac{0.1mol}{0.25L}$=0.4mol/L;
溶液是均匀的,取出10mL溶液的浓度与原溶液浓度相等,仍然为0.4mol/L;
取出10mL溶液中NaOH的物质的量=0.01L×0.4mol/L=0.004mol,将该10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为:$\frac{0.004mol}{0.1L}$=0.04mol/L,
故答案为:0.4;0.4; 0.04.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量与物质的量浓度之间的关系为解答关键,试题侧重基础知识的考查,培养了学生的化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
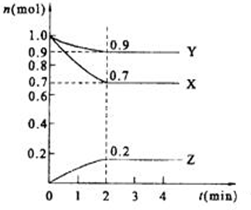 某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏 | B. | 分液 | C. | 过滤 | D. | 蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
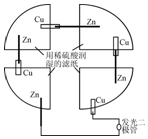 将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿.下列叙述正确的是( )
将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿.下列叙述正确的是( )| A. | 锌片上有气泡,铜片溶解 | B. | 电子都是从铜片经外电路流向锌片 | ||
| C. | Zn片发生还原反应 | D. | 该装置至少有两种形式的能量转换 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{n(A-N-2)}{A}$ mol | B. | $\frac{n(A-N+8)}{A+16}$mol | C. | $\frac{n(A-N+8)}{A+8}$mol | D. | $\frac{n(A-N+2)}{A}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com