
【题目】(1)请填写下表:
物质 | 摩尔质量 | 物质的量 | 质量 | 分子或离子数目 |
SO2 | ________ | 2 mol | ________ | ________ |
SO42- | ________ | ________ | ________ | 6.02×1022 |
O2 | ________ | ________ | 8.0 g | ________ |
(2)O2和O3是氧元素的两种单质。根据分子式回答。等质量的O2和O3所含分子数之比为____,原子个数比为____。
(3)摩尔质量是指单位物质的量的物质所含有的质量。
①已知NH3的相对分子质量为17,则NH3的摩尔质量为____。
②1.28 g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为____。
【答案】64 g·mol-1 128 g 1.204×1024 96 g·mol-1 0.1 mol 9.6 g 32 g·mol-1 0.25 mol 1.505×1023 3∶2 1∶1 17 g·mol-1 64 g·mol-1
【解析】
(1)SO2的摩尔质量为64g/mol,2mol二氧化硫的质量为2mol×64g/mol=128g,分子数目为2mol×6.02×1023mol-1=1.204×1024;
硫酸根离子的摩尔质量为96g/mol,6.02×1022个硫酸根离子的物质的量为![]() =0.1mol,质量为0.1mol×96g/mol=9.6g;
=0.1mol,质量为0.1mol×96g/mol=9.6g;
氧气的摩尔质量为32g/mol,8.0g氧气的物质的量为![]() ,分子数为0.25mol×6.02×1023mol-1=1.505×1023;
,分子数为0.25mol×6.02×1023mol-1=1.505×1023;
(2)等质量的O2和O3所含分子数之比为![]() ,原子数之比为
,原子数之比为![]() ;
;
(3)①摩尔质量是指单位物质的量的物质所含有的质量,以g/mol为单位时,在数值上等于该物质的相对分子质量,故NH3的摩尔质量为17g/mol;
②1.28 g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为 。
。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D均为短周期元素,它们在元素周期表中的相对位置如图所示,其中B的单质在空气中含量约占80%。
A | B | C | |||
D |
(1)写出下列元素的名称:C____,D___。
(2)画出B的原子结构示意图____。C在元素周期表中的位置是____。
(3)B、C两种元素最简单氢化物的稳定性由强到弱的顺序是_____。写出A的最简单氢化物的电子式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小王同学准备用CuSO4·5H2O配制500mL 1 mol/L的溶液。
(1)小王同学选用的玻璃仪器有:烧杯,玻璃棒,__________;________。
(2)玻璃棒在该实验中有重要的用途,分别是__________和 _________;
(3)小王同学通过计算,用托盘天平称取________gCuSO4·5H2O。
(4)物质的量浓度误差(填偏高、偏低、无影响)
①若容量瓶中洗净后未干燥,残留少量水,则所配制的溶液浓度将_________;
②定容时,若眼睛俯视,则所配制的溶液浓度将___________;
③摇匀后以免低于刻度线,再加入少量水________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。
(1)联氨分子的电子式为______________,
(2)联氨为二元弱碱,在水中的电离方式与氨相似。写出在水中联氨第一步电离反应的方程式______________________________________________________。
(3)已知12.8 g的液态高能燃料联氨在氧气中燃烧,生成气态N2和液态水,放出248.8kJ的热量。写出表示液态联氨燃烧热的热化学方程式___________________。
(4)已知①2O2(g)+N2(g)=N2O4(l) ;ΔH1
②N2(g)+2H2(g)=N2H4(l) ;ΔH2
③O2(g)+2H2(g)=2H2O(g) ; ΔH3
④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ;ΔH4
上述反应热效应之间的关系式为ΔH4=_________________,联氨和N2O4可作为火箭推进剂的主要原因为____________________________________________ (至少答2点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超顺磁性的Fe3O4粒子(粒子平均直径为25nm)在医疗上有重要作用,实验室制备方法如下:在有N2保护和剧烈搅拌条件下,向FeCl3、FeCl2混合溶液中滴加氨水,可得到黑色的Fe3O4。实验装置如图:
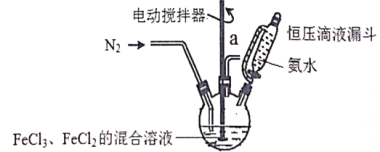
请回答下列问题:
(1)恒压滴液漏斗的优点是______________________。
(2)充N2的目的是___________,反应温度应控制在50℃,加热方法为___________。
(3)制备超顺磁性Fe3O4粒子反应原理的离子方程式为______________________。
(4)充分反应后,将三颈烧瓶中的混合物通过离心分离,然后水洗,最后用无水乙醇洗涤,用无水乙醇洗涤的优点是___________;为了验证得到的固体是超顺磁性的Fe3O4粒子,实验操作:_______________。为了检验超顺磁性粒子中含有+2价的铁,需要的化学试剂为___________(填代号)。
A.KSCN溶液 B.HCl溶液 C.H2O2溶液 D.K3[Fe(CN)6]溶液
(5)实验制得的超顺磁性的Fe3O4粒子中含有少量的Fe(OH)3,为测得Fe3O4的含量,称取mg试样,放在小烧杯中用足量稀硫酸溶解后定容于100mL容量瓶中,准确量取其中的20.00mL溶液置于锥形瓶中,然后用cmol/L的KMnO4溶液进行滴定,当______________________停止滴定,然后重复二次滴定,平均消耗KMnO4溶液ⅴmL,该样品的纯度为___________。(已知MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)在操作正确的前提下,提高中和热测定准确性的关键是_________
(2)做1次完整的中和热测定实验,温度计需使用________次,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么?__________,_____________________________
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等、不相等”),所求中和热__________(填“相等、不相等”),简述理由 ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔质量是指单位物质的量的物质所含有的质量。
(1)已知NH3的相对分子质量为17,则NH3的摩尔质量为____。
(2)NA为阿伏加德罗常数,已知a g某气体中含分子数为b,则该气体的摩尔质量为 ____。
(3)已知一个铁原子的质量为b g,则铁的摩尔质量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关煤的说法正确的是( )
A.煤的干馏、气化和液化都是物理变化
B.煤中含有苯、甲苯、二甲苯等芳香烃
C.通过煤的干馏可获得苯、甲苯等芳香烃
D.水煤气是通过煤的干馏得到的气体燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下(T1 <T2),可逆反应2X(g) ![]() 2Y(g)+Z(g) ΔH<0中,生成物Z在反应平衡混合物中的体积分数(
2Y(g)+Z(g) ΔH<0中,生成物Z在反应平衡混合物中的体积分数(![]() )与反应时间(t)的关系有以下图示,正确的是
)与反应时间(t)的关系有以下图示,正确的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com