
 %(或
%(或 ) ;偏高;
) ;偏高;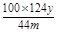 %(或
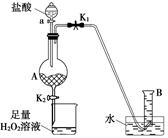
%(或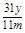 )若未进行步骤a,由于空气中含有CO2,会把空气中的二氧化碳当作是CuCO3反应产生的。所以将使测量结果偏高。Ⅱ(1)根据题意可知:步骤②中“……”的内容是待A中固体完全消失时。(2)FeCl2与H2O2反应的方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。(3)FeCl3是强碱弱酸盐,Fe3+水解使溶液而得到Fe(OH)3沉淀。所以为了抑制FeCl3水解,防止产生Fe(OH)3沉淀要加入适量的盐酸。
)若未进行步骤a,由于空气中含有CO2,会把空气中的二氧化碳当作是CuCO3反应产生的。所以将使测量结果偏高。Ⅱ(1)根据题意可知:步骤②中“……”的内容是待A中固体完全消失时。(2)FeCl2与H2O2反应的方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。(3)FeCl3是强碱弱酸盐,Fe3+水解使溶液而得到Fe(OH)3沉淀。所以为了抑制FeCl3水解,防止产生Fe(OH)3沉淀要加入适量的盐酸。

科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
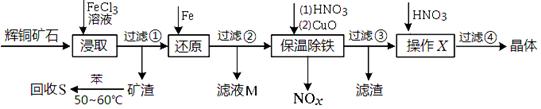
科目:高中化学 来源:不详 题型:实验题
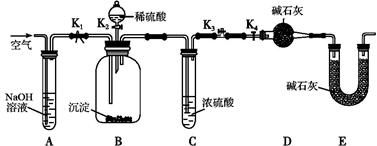
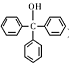 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图所示。
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图所示。

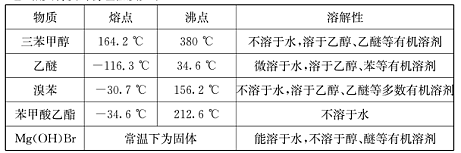
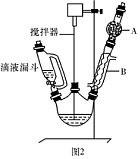

| A.水 | B.乙醚 | C.乙醇 | D.苯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
| B.加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
| C.加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
| D.加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
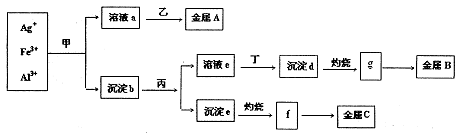
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
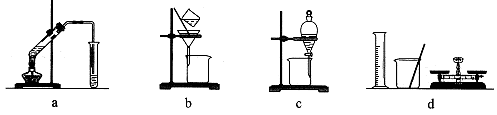
| A.a组:制备少量乙酸乙酯 |
| B.b组:除去粗盐水中的泥沙 |
| C.c组:用CCl4提取碘水中的碘 |
| D.d组:配制100 mL 1.00 mol/L NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.除去Na2CO3固体中的少量NaHCO3,置于坩埚中加热 |
| B.除去SO3中的少量SO2,可通入适量的O2 |
| C.除去合成氨中生产的NH3中的N2、H2,可采用降温的方法 |
| D.纯碱生产中所得的NH4Cl和NaHCO3混合物,可采用结晶过滤的方法分离 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com