
| A. | O3与SO2的结构相似 | B. | 硫粉不溶于水,易溶于CS2中 | ||
| C. | Be(OH)2是两性氢氧化物 | D. | 在相同条件下,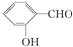 的沸点高于 的沸点高于 |
分析 A.SO2与O3中原子个数相等,电子总数不相同,但价电子总数相同,所以是等电子体,其空间构型相似;
B.依据相似相溶原理;
C.Be与Al处于对角线位置,Be(OH)2与氢氧化铝的性质相似;
D.前者形成分子内氢键,后者形成分子间氢键,分子内氢键使物质熔沸点降低;
解答 解:A.SO2与O3中原子个数相等,电子总数不相同,但价电子总数相同,所以是等电子体,其空间构型相似,故A正确;
B.硫、CS2都是非极性分子,依据相似相溶原理,硫易溶于二硫化碳,故B正确;
C.Be与Al处于对角线位置,Be(OH)2与氢氧化铝的性质相似,Be(OH)2是两性氢氧化物,故C正确;
D.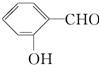 形成分子内氢键,
形成分子内氢键,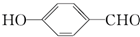 形成分子间氢键,分子间氢键使物质熔沸点升高,分子内氢键使物质熔沸点降低,故前者沸点低于后者的,故D错误;
形成分子间氢键,分子间氢键使物质熔沸点升高,分子内氢键使物质熔沸点降低,故前者沸点低于后者的,故D错误;
故选:D.
点评 本题考查分子结构与性质、元素周期律、氢键等,注意氢键对物质性质的影响,侧重考查学生对基础知识的掌握.


科目:高中化学 来源: 题型:解答题
 目前工业上制备丙烯腈(CH2=CHC≡N)有乙炔法、丙烯氨氧化法等.
目前工业上制备丙烯腈(CH2=CHC≡N)有乙炔法、丙烯氨氧化法等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
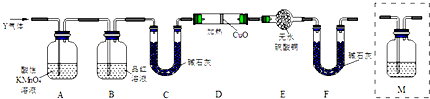
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 . H2O2
. H2O2 NH4Cl
NH4Cl
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
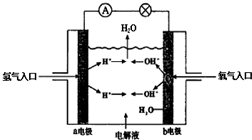
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
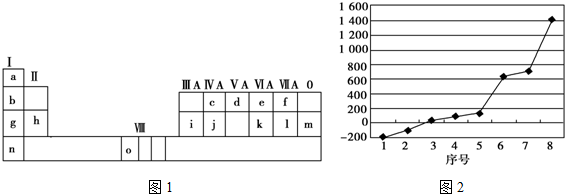
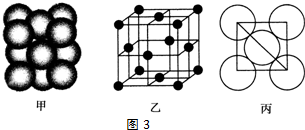
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com