
| A. | X2为0.2mol/L | B. | Y2为0.2mol/L | C. | Z为0.3mol/L | D. | Z为0.45mol/L |
分析 X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,可极限转化为反应物或生成物,但不能完全转化,以此来解答.
解答 解:已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,
若极限转化为反应物,由X2(g)+Y2(g)?2Z(g)可知,生成的反应物均为0.1mol/L,则c(X2)<0.2mol/L,c(Y2)<0.4mol/L;
若X2极限转化为生成物,由X2(g)+Y2(g)?2Z(g)可知,生成Z为0.2mol,则c(Z)<0.4mol/L,消耗Y2为0.1mol/L,则c(Y2)>0.2mol/L,
综合所述,Z为0.3mol/L可能,
故选C.
点评 本题考查化学平衡的计算,为高频考点,把握反应物、生成物的浓度关系、极限转化法为解答的关键,侧重分析与计算能力的考查,注意可逆反应的特征,题目难度不大.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | 将煤粉碎后燃烧 | B. | 通入大量的空气 | ||
| C. | 加入的煤越多越好 | D. | 将煤和空气在密闭的空间里燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 124 g P4含有P-P键的个数为4NA | |
| B. | 60gSiO2中含Si-O键的个数为2NA | |
| C. | 12 g石墨中含有C-C键的个数为1.5NA | |
| D. | 36 g戊烷中共价键的个数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:Cl>Br | B. | 酸性:H2SO3>H2CO3 | ||
| C. | 碱性:KOH>NaOH | D. | 热稳定性:NH3>PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯中的甲苯(溴水) | B. | 溴苯中的溴(苯) | ||
| C. | 乙烷中的乙烯(酸性高锰酸钾) | D. | 95.6%乙醇中的水(生石灰) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 原子结构或性质 |
| A | 其形成的一种同位素元素在考古中可推测化石的年代 |
| B | 与A同周期,其最高价氧化物的水化物无论浓、稀溶液均有强氧化性 |
| C | 地壳中含量最多的元素 |
| D | D原子的最外层电子数与其电子层数相同,是地壳中含量最多的金属元素 |
| E | 其单质主要存在于火山口附近 |
| F | 生活中常见的金属,它的某种氧化物均有磁性 |
| G | G原子与D原子同周期,且原子半径是同周期元素中最大的 |
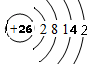 ;
; ,
,
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{14}$ mol•L-1 | B. | $\frac{4}{5}$ mol•L-1 | C. | $\frac{1}{28}$ mol•L-1 | D. | $\frac{1}{42}$ mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 相 关 信 息 |
| A | 原子核外有7种运动状态不同的电子 |
| B | 外围电子排布式为nsnnpn+2 |
| C | 常见的金属,在周期表中周期序数与族序数相等 |
| D | 气态氢化物及最高价氧化物对应的水化物均为强酸 |
| E | 一种核素的质量数为56,中子数为30 |
| F | 单质紫红色,电缆材料,常见氧化物为黑色 |
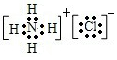
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com