
| A.Mg、Fe | B.Zn、Ag | C.Al、Zn | D.Mg、Al |


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源:不详 题型:单选题
A.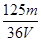 mol/L mol/L | B.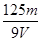 mol/L mol/L | C.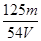 mol/L mol/L | D.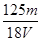 mol/L mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.标准状况下,1.12 L16O2和1.12 L18O2均含有0.1NA个氧原子 |
| B.第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| C.能使甲基橙显红色的溶液中大量存在:Mg2+、Fe2+、Cl—、NO—3 |
| D.从C(石墨)=C(金刚石);ΔH=+1.9 kJ·mol-1,可知金刚石比石墨更稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.3∶2∶2 | B.1∶2∶3 | C.1∶3∶3 | D.3∶1∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.134.4L | B.67.2L | C.44.8L | D.537.6L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA |
| B.标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA |
| C.常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA |
| D.10 mL质量分数为98%的H2SO4溶液,用水稀释至100 mL,H2SO4的质量分数为9.8% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1mol铁与1molCl2充分反应,转移电子数为3NA |
| B.常温常压下,22.4L NH3所含的分子数为NA |
| C.常温下,44g CO2中含有2NA个C=O键 |
| D.1mol/L的A1C13溶液中,Al3+离子的数目略小于NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将28 g Fe投人到1 Ll mol/L的硫酸中,可得到11.2 LH2 |
| B.常温常压下,64 gSO2气体含有的原子数目为3 NA |
| C.25℃时pH =13的NaOH溶液中含有OH一的数目为0. 1 NA |
| D.1 mo1N a被完全氧化生成Na2O2,失去2 NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com