
| ������ | �� | 0 | ||||||
| 1 | �� | �� | �� | �� | �� | �� | �� | |
| 2 | �� | �� | ||||||
| 3 | �� | �� | �� | �� |
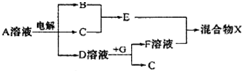
| 0.01mol |
| 2 |


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������Һ��c��D+��=c��OD-��=4��10-8mol/L |
| B�������¶Ȳ��䣬����ˮ��ͨ��һ������HCl���壬D2O����̶ȼ�С |
| C���ܽ�0.01molDCl�õ�1LD2O��Һ����pD=2 |
| D����100mL0.2mol/L��DCl��ˮ��Һ�У�����50mL0.2mol/L��NaOD����ˮ��Һ�����Ի�Ϻ�����仯������Ϻ���ҺpD=1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
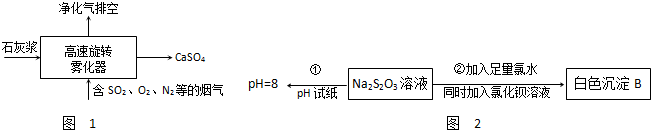
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
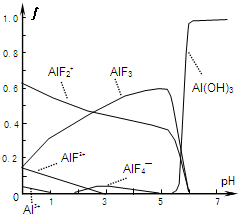 ���ͷ����ǻ���ԭ�ϣ����ڷ������ʻ��ã���������ȡ��������1������ͨ����ⴿ����Һ̬HF���F2����ԭ����
���ͷ����ǻ���ԭ�ϣ����ڷ������ʻ��ã���������ȡ��������1������ͨ����ⴿ����Һ̬HF���F2����ԭ����| �¶�/�� | 1500 | 1800 | 2400 |
| ƽ�ⳣ��K | 8.0��10-5 | 3.0��10-4 | 6.4��10-3 |
| ����ƽ�ⳣ�� | |||
| ������ | Ka1=7.1��10-4 | Ka2=1.68��10-5 | Ka3=4.1��10-7 |
| ������ | Ka=4.93��10-10 | ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
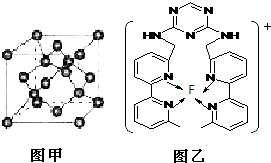 ����A��B��C��D��E��Fԭ�������������������Ԫ�أ�����λ��Ԫ�����ڱ���ǰ�����ڣ�AԪ���ܼ�����������������ȣ�BԪ�غ���3���ܼ�����ÿ���ܼ������ĵ�������ͬ��D��ԭ�Ӻ�����8���˶�״̬��ͬ�ĵ��ӣ�EԪ����FԪ�ش���ͬһ�������ڵ��壬���ǵ�ԭ���������3����EԪ�صĻ�̬ԭ����4��δ�ɶԵ��ӣ���ش��������⣺
����A��B��C��D��E��Fԭ�������������������Ԫ�أ�����λ��Ԫ�����ڱ���ǰ�����ڣ�AԪ���ܼ�����������������ȣ�BԪ�غ���3���ܼ�����ÿ���ܼ������ĵ�������ͬ��D��ԭ�Ӻ�����8���˶�״̬��ͬ�ĵ��ӣ�EԪ����FԪ�ش���ͬһ�������ڵ��壬���ǵ�ԭ���������3����EԪ�صĻ�̬ԭ����4��δ�ɶԵ��ӣ���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� | Ka1 | Ka2 |
| H2C2O4 | 5.9��10-2 | 6.4��10-5 |
| H2CO3 | 4.2��10-7 | 5.6��10-11 |
| H2SO3 | 1.3��10-2 | 5.6��10-8 |
| HClO | 4.7��10-10 | |
| CH3COOH | 1.6��10-5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����õ����ǵĽ������� |
| B����ʹ�����й©�ĵ��Һ��ʴ������Ʒ |
| C����������ʯī�缫 |
| D����ֹ����й����Ӻ�Ǧ���ؽ������Ӷ�ˮ����������Ⱦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ȥ��ҵ��ˮ�е�Cu2+����ѡ��FeS�������� |
| B��������CuSO4�ܽ���0.1mol?L-1 H2S��Һ�У�Cu2+�����Ũ��Ϊ1.3��10-35mol?L-1 |
| C����ΪH2SO4��ǿ�ᣬ���Է�ӦCuSO4+H2S�TCuS��+H2SO4���ܷ��� |
| D����H2S�ı�����Һ��ͨ������SO2������Һ��������ǿ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com