
| 试剂组合序号 | 固体试剂 | NH3体积(mL) | |
| a | 6.0g Ca(OH)2(过量) | 5.4g NH4Cl | 1344 |
| b | 5.4g (NH4)2SO4 | 1364 | |
| c | 6.0g NaOH(过量) | 5.4g NH4Cl | 1568 |
| d | 5.4g (NH4)2SO4 | 1559 | |
| e | 6.0g CaO(过量) | 5.4g NH4Cl | 1753 |
| f | 5.4g (NH4)2SO4 | 1792 | |
 →
→

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
| A、鉴别食盐和小苏打 |
| B、检验食盐中是否含KIO3 |
| C、检验自来水中是否含有氯离子 |
| D、检验白酒中是否含甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在2mL10%的氢氧化钠溶液中滴入2%的硫酸铜溶液4~6滴,配制新制氢氧化铜悬浊液,检验醛基 |
| B、实验室制乙烯时,迅速升温到140℃ |
| C、用乙醇和浓硫酸除去乙酸乙酯中混有的少量乙酸 |
| D、用苯、2mol/L的硝酸和3mol/L的硫酸制硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
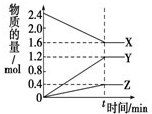 (1)在一个容积为2L的密闭容器中,充入1mol SO2和1mol O2,一定条件下发生反应2SO2+O2?2SO3,3分钟后测得SO3的物质的量为0.6mol,则此时O2的物质的量浓度为
(1)在一个容积为2L的密闭容器中,充入1mol SO2和1mol O2,一定条件下发生反应2SO2+O2?2SO3,3分钟后测得SO3的物质的量为0.6mol,则此时O2的物质的量浓度为查看答案和解析>>
科目:高中化学 来源: 题型:
 一定条件下,在2L的密闭容器中,发生下述反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol
一定条件下,在2L的密闭容器中,发生下述反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:
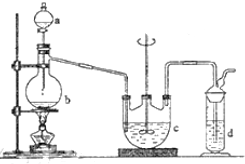 硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.回答下列问题:
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
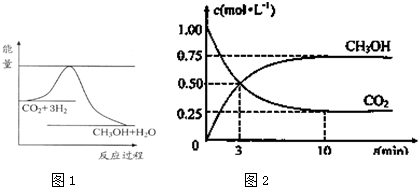
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Ba2+、Cl-、NO3- |
| B、Ba2+、Hg2+、S2-、SO42- |
| C、NH4+、H+、SO32-、PO43- |
| D、ClO-、Al3+、Br-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com